Acqua ossigenata
Proprietà e caratteristiche dell'acqua ossigenata. Vendita acqua ossigenata
L'acqua ossigenata, nota anche con il nome di perossido di idrogeno è un composto inorganico con formula chimica H2O2.
È stata ottenuta per la prima volta da Thenard nel 1818 facendo agire l'acido cloridrico sul perossido di bario.
Si trova in minima quantità nell'atmosfera dopo forti scariche elettriche o dopo nevicate. Un chilogrammo di neve può contenere fino ad 1 milligrammo di perossido di idrogeno.
Il perossido di idrogeno si forma sempre quando si fa agire l'idrogeno in forma attiva (per esempio, adsorbito in palladio, o allo stato nascente, o sviluppato elettroliticamente) su ossigeno molecolare sciolto in acqua; inoltre, si forma per lenta ossidazione di diverse sostanze inorganiche ed organiche da parte dell'ossigeno atmosferico.
Proprietà dell'acqua ossigenata
Il perossido di idrogeno puro è un liquido vischioso, incolore (azzurro in forti spessori) capace di svolgere un volume di ossigeno pari a 475 volte il proprio volume.
La concentrazione delle soluzioni acquose di perossido di idrogeno può essere espressa in % in peso, ossia in grammi di H2O2 per 100 g di soluzione, oppure in % in volume, ossia in grammi di H2O2 per 100 cm3 di soluzione, od in volume di ossigeno attivo che un volume di soluzione può sviluppare.
Alla temperatura ordinaria il perossido di idrogeno emette vapori aventi un odore repellente, come quelli dell'acido nitrico e decompone sviluppando ossigeno:
2 H2O2 → 2 H2O + O2
Il perossido di idrogeno è un composto diamagnetico; ha una costante dielettrica di 84,9 a O°C, vicina quindi a quella dell'acqua (si veda: costante dielettrica dell'acqua), che si innalza per miscela con essa fino a raggiungere il valore massimo di 89,8 per un contenuto in perossido del 53,5% in peso.
Il perossido di idrogeno puro è stabile ad un riscaldamento non troppo intenso; la stabilità però è fortemente influenzata dal grado di purezza, infatti la decomposizione secondo l'equazione:
2 H2O2 → 2 H2O + O2
dipende da numerosi fattori, come temperatura, pH, radiazioni (specie a corta lunghezza d'onda) e, soprattutto, da tracce di cationi "catalizzanti" (ad esempio ferro, vanadio, nichel, cromo, manganese) o da sostanze in sospensione (come particelle di polvere) o, infine, dal contatto con superfici cataliticamente attive.
Catalizzatori eterogenei, come cristalli piccolissimi di argento, metalli del platino, manganese ed i suoi ossidi, ferro, rame, polvere di carbone, ed in particolare l'osmio colloidale provocano la decomposizione del perossido di idrogeno; analogamente, soluzioni concentrate di acqua ossigenata possono provocare esplosioni quando in esse cadano particelle di polvere. La velocità di questo processo di decomposizione dipende dalla superficie del catalizzatore.
Vi sono d'altra parte superfici che non catalizzano apprezzabilmente la decomposizione; fra esse il vetro Pyrex, il quarzo, resine poliviniliche ed acriliche, l'alluminio e leghe alluminio-magnesio.
Per i recipienti destinati al trasporto del perossido di idrogeno concentrato, si usa pertanto alluminio (puro oltre il 99,5%).
Gli ioni ossidrile provocano una decomposizione rapida; sono sufficienti le tracce di alcalinità ceduta dal vetro normale. Studi sull'influenza del pH nella decomposizione del perossido di idrogeno hanno dimostrato che la massima stabilità si ha attorno a pH = 4 (pH acido).
Infine alcuni enzimi, le catalasi, possono decomporre il perossido di idrogeno; una sola molecola di enzima, a 0°C, può decomporre fino a 2000 molecole di perossido al secondo. Queste catalasi sono presenti nel sangue e nei tessuti animali.
Sono note, d'altra parte, sostanze che impediscono o rallentano la decomposizione del perossido di idrogeno e che quindi agiscono come stabilizzanti dell'acqua ossigenata, soprattutto perché possono rendere inattivi i catalizzatori della decomposizione; alcune infatti formano complessi solubili con gli ioni metallici (tali sono i fosfati, i fluoruri, i cianuri, l'urea, l'8-idrossichinolina, ed il pirofosfato di sodio) mentre altre formano sospensioni di colloidi che possono adsorbire i cationi metallici (appartengono a questo tipo la silice, l'idrossido di alluminio precipitato di fresco, lo stannato sodico, l'ossido stannico idrato, le proteine, la colla, la gelatina, la caseina).
L'aggiunta di piccole quantità di stabilizzante non è nociva per la maggior parte degli impieghi del perossido di idrogeno; per questo le soluzioni di acqua ossigenata, anche ad alta concentrazione, vengono oggi stabilizzate con l'aggiunta delle suddette sostanze e possono quindi essere conservate anche in recipienti di vetro.
L'acqua ossigenata può anche dissociarsi in radicali liberi, secondo le reazioni:
HOOH → H· + ·OOH
HOOH → 2 ·OH
la seconda delle quali, richiedendo meno energia, predomina nella decomposizione del vapore, non catalizzata, e nelle reazioni fotochimiche.
Nella decomposizione catalizzata, specialmente in soluzione, il tipo di catalizzatore determina il prevalere dell'una o dell'altra reazione.
L'acqua ossigenata presenta un carattere acido molto debole. Allo stato anidro non arrossa la tintura di tornasole, mentre in soluzione si comporta come acido più debole dell'acido carbonico. Il valore della costante di dissociazione secondo l'equilibrio:
H2O2 ⇄ H+ + HO2−
è:
K = [H+] · [HO2−] / [H2O2]
è 1,55 · 10-12 a 20°C.
Comportamento ossidante e riducente del perossido di idrogeno
Il perossido di idrogeno può comportarsi da ossidante e da riducente: in generale, ossida facilmente i composti aventi un potenziale di ossidazione più basso e riduce quelli con potenziale di ossidazione superiore. I potenziali di ossido-riduzione, in soluzione acquosa, sono i seguenti:
![]()
![]()
![]()
da cui si può dedurre che, solo nei confronti di forti ossidanti, il perossido di idrogeno agisce da riducente.
Il carattere riducente del perossido di idrogeno si può osservare nella riduzione, in ambiente acido, del permanganato di potassio a sali manganosi, degli ipocloriti a cloruri, nella riduzione del cloro ad acido cloridrico, del solfato cerico ed altri forti ossidanti; dalle soluzioni acide dei sali aurici viene precipitato il metallo.
Il carattere ossidante del perossido di idrogeno si manifesta nella trasformazione: dell'acido solforoso e dei suoi sali in acido solforico e solfati, dell'acido nitroso in acido nitrico, dell'acido arsenioso in arsenico, dell'acido iodidrico a iodio, del solfuro di arsenico in acido arsenico ed acido solforico, dei sali di cromo trivalente (in ambiente alcalino) a cromato, ecc.
I metalli vengono trasformati in ossidi e di conseguenza aumenta la loro solubilità negli acidi, così, per esempio, argento, mercurio, rame, in presenza d'acqua ossigenata si sciolgono in acido solforico diluito.
Inoltre il perossido di idrogeno ha la proprietà di decolorare l'indaco ed altre sostanze per cui si usa come sbiancante.
Il potere ossidante del perossido di idrogeno viene esaltato da adatti catalizzatori, specifici per la sua decomposizione. Così, in presenza di sali ferrosi (reattivo di Jenton) trasforma l'alcool etilico in acido acetico.
Il comportarsi da ossidante o da riducente, dipende anche dal mezzo in cui avviene la reazione; ad esempio in ambiente neutro od acido alcuni metalli, come argento e mercurio, sono trasformati in ossidi mediante il perossido di idrogeno, mentre in ambiente alcalino essi possono venire precipitati dai loro sali, dopo riduzione a metalli.
Per il suo carattere acido il perossido di idrogeno reagisce con le basi forti per dare perossidi, come il perossido di sodio, Na2O2, il perossido di bario, BaO2, i perossidi di magnesio e di calcio.
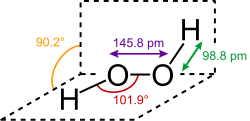
Struttura del perossido di idrogeno
La struttura del perossido di idrogeno, ormai ben conosciuta, ha costituito argomento di numerosi lavori e discussioni.
I dati teorici, spettroscopici, cristallografici sono oggi a supporto della struttura proposta da Penny e Sutherland nel 1934. Gli angoli e le distanze di legame sono quelli riportati nella figura seguente:
Preparazione del perossido di idrogeno
Numerosi sono i modi con cui si può ottenere il perossido di idrogeno.
Si è tentato di ottenere il perossido di idrogeno su scala industriale, sottoponendo una miscela di idrogeno ed ossigeno a scariche elettriche. Nonostante i numerosi brevetti richiesti al riguardo, questo metodo non ha, a tutt'oggi, importanza industriale.
Sintesi del perossido di idrogeno dal perossido di bario
Prima del 1910 il perossido di idrogeno si otteneva quasi esclusivamente per reazione del perossido di bario con acido solforico:
BaO2 + H2SO4 → BaSO4 + H2O2
In modo analogo può essere utilizzato perossido di sodio a posto del perossido di bario.
Sintesi del perossido di idrogeno attraverso il processo elettrolitico
Questo metodo consiste essenzialmente nell'elettrolisi di una soluzione concentrata di acido solforico o solfati, per ottenere l'acido perossidisolforico, H2S2O8 od i suoi sali, in presenza di un eccesso di acido solforico:
2 HSO4− → H2S2O8 + 2e−
e nella successiva idrolisi dell'acido ottenuto, in ambiente acido:
H2S2O8 + 2 H2O → H2O2 + 2 H2SO4
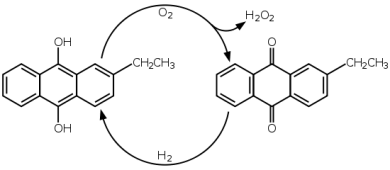
Un altro metodo di sintesi del perossido di idrogeno è attraverso il processo di auto-ossidazione dell'antrachinone:
Usi dell'acqua ossigenata
A parte le usuali applicazioni delle soluzioni acquose diluite di H2O2 (come disinfettante, in cosmesi, nel restauro delle pitture antiche a base di colori al piombo ed in alcuni processi fotografici), le soluzioni concentrate vengono adoperate nella sbianca di fibre tessili pregiate (lana, cotone e seta), della cellulosa e del legno, nella decolorazione dei grassi, in pellicceria, nella preparazione di composti organici, nell'analisi chimica.
Altre applicazioni sono : come ossidante (per coloranti al tino, per la separazione di ioni metallici mediante ossidazione selettiva) e come sorgente di radicali liberi.
Per la capacità di svolgere gas, le soluzioni diluite di perossido di idrogeno possono essere usate come schiumogeni nella preparazione di sostanze porose (gomma ed alcuni materiali da costruzione).
Del perossido di idrogeno utilizzato industrialmente, si può considerare che il 40% sia impiegato dall'industria tessile, il 20% da quella chimica, il 15% dall'industria cartaria, ed il restante 25% per usi vari.
Attualmente, nell'industria chimica il principale uso dell'acqua ossigenata è l'ossidazione di composti organici: il perossido di idrogeno può essere usato come tale o convertito in acido perossiacetico.
Il perossido di idrogeno è inoltre usato nella sintesi della glicerina dal propilene, nell'ossidazione delle ammine terziarie ai loro ossidi, nell'ossidazione dei composti organici solforati. Inoltre numerosi perossidi organici vengono oggi ottenuti mediante l'uso del perossido di idrogeno ; essi sono usati come catalizzatori della polimerizzazione radicalica, reagenti per formare legami incrociati nei polimeri, e ossidanti.
Infine, uno dei maggiori usi del perossido di idrogeno molto concentrato è quello di propellente per razzi; esso può essere usato da solo e si decompone in vapore e ossigeno (i gas caldi vengono usati come fonte di energia); oppure viene usato per ossidare altri combustibili, ottenendo una quantità di energia ancora maggiore. Queste possibilità di impiego hanno dato, sia nel corso della seconda guerra mondiale in Germania, sia nel periodo immediatamente successivo, un grande impulso alle ricerche sulle proprietà di questo composto.
Vendita di acqua ossigenata
È possibile acquistare acqua ossigenata collegandosi ad uno dei seguenti link:
Link correlati:
Quali sono i numeri di ossidazione dell'idrogeno e dell'ossigeno in H2O2?
Studia con noi