Vapore
Che cos'è il vapore?
Il vapore è un particolare stato aeriforme della materia ottenuto dall'evaporazione o dall'ebollizione di una sostanza allo stato liquido o, in certi casi particolari, dalla sublimazione di una sostanza allo stato solido (come nel caso dello iodio).
In modo più specifico si definisce vapore una specie chimica gassosa che si trova al di sotto della sua temperatura critica.
La temperatura critica di una specie chimica è quella temperatura al di sotto della quale è possibile liquefarla per semplice compressione (ovvero tramite un aumento di pressione). È questa la vera differenza tra vapore e gas:
- un gas è un aeriforme che si trova ad una temperatura superiore alla sua temperatura critica; il gas non è liquefacibile per compressione.
- un vapore è un aeriforme che si trova ad una temperatura inferiore alla sua temperatura critica; il vapore è liquefacibile per compressione.
Quando una specie chimica è definita "vapore"?
In base a quanto detto in precedenza, una stessa specie chimica può comportarsi da gas o da vapore a seconda che si trovi ad una temperatura superiore o inferiore alla sua temperatura critica.
In pratica, è d'uso corrente attribuire il nome di vapore a quelle specie chimiche aeriformi la cui temperatura critica è nettamente al di sopra della temperatura ambiente.
Così l'ammoniaca (tcr = 132,5 °C) è un vapore, il vapore acqueo (tcr = 373,936°C) è un vapore, ecc.
Queste sostanze, a temperatura ambiente, sono liquefacibili per semplice compressione; il metano (tcr = -82,1 °C) è invece un gas e non può essere liquefatto per sola compressione.
Bisogna ricordare infine che, molto spesso, con il termine generico di vapore si intende il vapore acqueo.
Come si forma il valore?
Il vapore si può formare attraverso due trasformazioni fisiche note come evaporazione ed ebollizione.
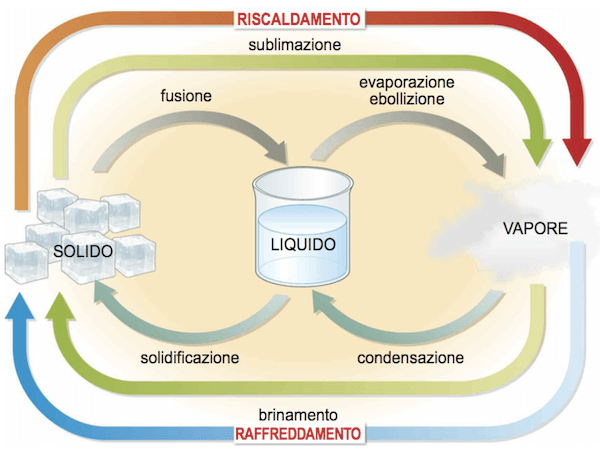
Per evaporazione ed ebollizione si intende il passaggio di un corpo dallo stato liquido allo stato di vapore.
L'evaporazione è il passaggio di un corpo dallo stato liquido allo stato di vapore; tale trasformazione avviene con acquisto di calore ed è quindi un processo endotermico ma che, a differenza dell'ebollizione, riguarda solo la superficie del liquido; l'evaporazione di un liquido è tanto più rapida quanto maggiore è la temperatura e si arresta soltanto quando tutto il liquido è evaporato.
L'ebollizione è il passaggio di un corpo dallo stato liquido allo stato di vapore ma che, a differenza dell'evaporazione, riguarda tutta la massa del liquido ed è caratterizzata dal formarsi di bolle, che, risalendo in superficie, sfuggono attraverso essa. A differenza dell'evaporazione che può avvenire a diverse temperatura (si pensi all'evaporazione dell'acqua che può avvenire indistintamente a 10°C, 20°C, ... 70°C, ecc.), l'ebollizione avviene, per una stabilita pressione, ad una determinata temperatura (100°C per l'acqua distillata alla pressione di 1 atm).
Pressione di vapore
Immaginiamo di riempire parzialmente con un liquido (ad esempio acqua) un recipiente chiuso nel quale sia stato fatto precedentemente il vuoto e che sia mantenuto a temperatura costante.
Il liquido inizia ad evaporare e, dopo un po' di tempo, succede che il vapore è in equilibrio con il liquido: il numero di particelle che abbandona la superficie del liquido diventa uguale al numero di particelle che nello stesso tempo vi ritornano.
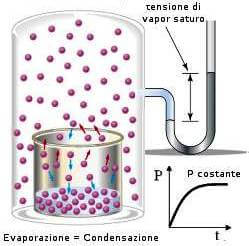
Una volta raggiunto l'equilibrio, la pressione esercitata dal vapore sulle pareti interne del recipiente è detta pressione di vapore (o tensione di vapore) il cui valore dipende dalla temperatura del sistema.
Vapore saturo umido, secco, surriscaldato e soprasaturo
Quando il vapore si trova in equilibrio con la fase liquida, come nell'esempio precedente, il vapore si dice saturo.
Più in particolare, il vapore saturo, ma ancora in presenza della fase liquida, si dice vapore saturo umido; quando la fase liquida è completamente evaporata, si parla di vapore saturo secco e, infine, quando la temperatura del vapore saturo secco aumenta ulteriormente (restando sempre però al di sotto della temperatura critica), si parla di vapore surriscaldato: in queste condizioni il comportamento del vapore si accosta al massimo a quello dei gas.
Il vapore può infine trovarsi in uno stato metastabile, nel quale viene detto vapore soprasaturo.
Link correlati:
Quiz online sulla materia
Passaggio di stato da gas a solido
Studia con noi