Acido solforoso
Proprietà e caratteristiche dell'acido solforoso
L'acido solforoso è un acido ternario con formula chimica H2SO3.
Non lo si conosce allo stato libero ma unicamente in soluzione acquosa.
Deriva formalmente dalla reazione chimica dell'anidride solforosa (SO2) con l'acqua:
SO2 + H2O → H2SO3
In realtà ciò non è proprio esatto: infatti nelle soluzioni acquose di SO2 sono presenti soprattutto idrati del tipo SO2·nH2O e solo piccole percentuali di H2SO3; la presenza - in piccole quantità - dello HS2O5− è invece giustificata dal seguente equilibrio:
HSO3− + SO2 ⇄ HS2O5−
La struttura chimica dell'acido solforoso è la seguente:
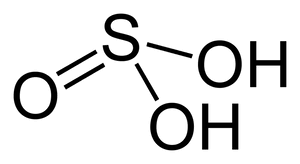
L'acido solforoso appartiene alla categoria degli acidi diprotici, ovvero alla categoria di quegli acidi che in soluzione acquosa possono fornire due protoni.
La prima dissociazione:
H2SO3(aq) ⇄ HSO3−(aq) + H+(aq)
è di media intensità con Ka1 = 1,6 · 10-2.
La seconda dissociazione:
HSO3−(aq) ⇄ H+(aq) + SO32−(aq)
è molto debole (Ka2 = 10-7). In seconda dissociazione H2SO3 si comporta quindi come un acido debole.
Le soluzioni di acido solforoso possiedono proprietà riducenti e riducono, ad esempio, lo iodio I2 a ione ioduro I−:
H2SO3 + I2 + H2O → 2 HI + H2SO4
Le soluzioni di acido solforoso vengono invece ossidate dall'ossigeno dell'aria e l'ossidazione è catalizzata dalla presenza di tracce di ioni metallici come ad esempio Fe2+ e Cu2+:
2 SO32− + O2 → 2 SO42−
I due gruppi OH dell'H2SO3 possono essere sostituiti da atomi di alogeni formano così i composti di tionile. Il cloruro di tionile, ad esempio, può prepararsi secondo la reazione:
PCl5 + SO2 → OPCl3 + OSCl2
Sali dell'acido solforoso
I sali dell'acido solforoso sono i solfiti. Tra essi ricordiamo il solfito di sodio Na2SO3, il solfito di potassio K2SO3 e il solfito di calcio CaSO3.
Oltre ai solfiti sono noti anche gli idrogenosolfiti, caratterizzati dalla presenza dell'anione HSO3−. Ne è un esempio l'idrogenosolfito di sodio NaHSO3, noto anche con il nome di bisolfito di sodio.
Studia con noi