Acido cloridrico
Proprietà e caratteristiche dell'acido cloridrico.
L'acido cloridrico è un acido binario con formula chimica HCl.
A temperatura e pressione ambiente è un gas incolore (in questo caso si parla di cloruro di idrogeno) ed è estremamente corrosivo.
Ha un odore pungente; è molto solubile in acqua ed è tossico se respirato in grande concentrazione.
È un componente essenziale del succo gastrico dei mammiferi, in quello dell'uomo è presente per lo 0,2-0,5%.
In piccole quantità si trova come gas HCl nelle emanazioni vulcaniche.
L'acido cloridrico venne preparato già nel XV secolo da Basilio Valentino per distillazione del cloruro di sodio con solfato ferroso (vetriolo di ferro). Glauber nel XVII secolo impiegò invece cloruro di sodio ed acido solforico.
L'acido cloridrico allo stato puro fu ottenuto da Priestley nel 1772 e Davy ne dimostrò la composizione nel 1810.
Industrialmente venne dapprima ottenuto come sottoprodotto della preparazione del carbonato di sodio col metodo Leblanc, trattando cloruro sodico con acido solforico.
Con lo sviluppo dell'elettrolisi dei cloruri alcalini, che ha messo a disposizione ingenti quantità di cloro, ha assunto oggi importanza essenziale la preparazione sintetica del cloruro di idrogeno da cloro ed idrogeno.
Proprietà chimiche dell'acido cloridrico
Il cloruro d'idrogeno è un composto relativamente stabile che fino a 1500°C ha poca tendenza a dissociarsi negli elementi.
Anidro non è molto attivo, mentre lo è assai più in soluzione acquosa, in cui si presenta notevolmente dissociato, comportandosi quindi da acido forte.
HCl + H2O → H3O+ + Cl−
Ovvero, in forma semplificata:
HCl → H+ + Cl−
L'acido cloridrico reagisce con i metalli che precedono l'idrogeno nella serie elettrochimica, con gli ossidi e gli idrossidi metallici per formare cloruri:
2 K + 2 HCl → 2 KCl + H2
CaO + 2 HCl → CaCl2 + H2O
Ca(OH)2 + 2 HCl → CaCl2 + 2 H2O
Ad alta temperatura il cloruro d'idrogeno gassoso attacca in modo insignificante il ferro.
Reagisce con gli idrocarburi saturi e non saturi per dare composti di sostituzione e con la maggior parte dei sali trasformandoli in cloruri e liberando gli acidi corrispondenti.
L'acido cloridrico è un potente veleno per l'uomo, per gli animali e le piante.
Struttura a puntini di Lewis nel cloruro di idrogeno
Nella molecola del cloruro di idrogeno è presente un legame covalente fortemente polarizzato.
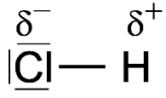
Struttura 3D
pH di una soluzione di acido cloridrico
Il cloruro di idrogeno (gas) è molto solubile in acqua. Quando disciolto in acqua HCl è completamente ionizzato:
HCl + H2O → H3O+ + Cl−
Pertanto le soluzioni di HCl hanno un pH acido.
Si veda "calcolo del pH di una soluzione di HCl" per approfondimenti.
Preparazione dell'acido cloridrico
La preparazione tecnica dell'acido cloridrico consta di tre fasi:
a) formazione dell'acido;
b) assorbimento in acqua;
c) purificazione.
La formazione dell'acido può avvenire attraverso diversi processi.
Formazione da cloruro di sodio ed acido solforico
Il cloruro di sodio e l'acido solforico reagiscono facilmente tra loro. Come reagenti si usano il sale comune (salgemma, sale marino o sale d'evaporazione) e l'acido solforico a 60-65 °Bè.
La reazione evolve in due stadi: nel primo stadio fatto avvenire alla temperatura di 150°C si ottiene idrogenosolfato di sodio; nel secondo stadio, condotto ad una temperatura di 500°C si ottiene il solfato neutro.
NaCl + H2SO4 → NaHSO4 + HCl
NaCl + NaHSO4 → Na2SO4 + HCl
- - - - - - - - - - - - - - - - - - - - - - - - -
2 NaCl + H2SO4 → Na2SO4 + 2 HCl
L'industria dell'acido cloridrico da cloruro di sodio ed acido solforico è ormai limitata alla produzione del solfato di sodio.
Sintesi diretta degli elementi
Con lo sviluppo della elettrolisi dei cloruri alcalini per la preparazione degli alcali caustici, si è avuta una sovrapproduzione di cloro che ha portato ad elaborare un procedimento conveniente per unirlo all'idrogeno, che si sviluppa contemporaneamente, per formare cloruro di idrogeno.
La sintesi dell'acido cloridrico dagli elementi dà un prodotto molto puro e molto concentrato, senza sottoprodotti: l'acido cloridrico viene ottenuto con questo metodo ad una concentrazione del 98% che, dopo purificazione, può raggiungere il 99,7 %. Nelle sintesi organiche si richiede appunto un gas ad alta purezza.
La reazione, fortemente esotermica, è la seguente:
H2 + Cl2 → 2 HCl + 44 kcal
Acido cloridrico ottenuto come sottoprodotto
L'acido cloridrico si forma come sottoprodotto nella clorurazione di composti organici. Queste clorurazioni sono diventate oggi sorgenti di notevoli quantità di acido cloridrico.
Il cloruro d'idrogeno che si svolge nella clorurazione è esente dalle comuni impurezze, come arsenico, selenio ed acido solforico, però contiene sostanze organiche che per molti usi non sono desiderabili.
La natura delle impurezze varia da un processo di clorurazione all'altro, per cui la separazione dell'acido cloridrico da queste miscele varia da caso a caso.
Analisi dell'acido cloridrico
Il contenuto in acido cloridrico delle soluzioni si può conoscere determinando, con l'aiuto del densimetro, la densità delle soluzioni e servendosi di opportune tabelle di conversione. Questo è possibile solo quando si tratti di un acido chimicamente puro.
Alternativamente si può titolare direttamente l'acido cloridrico con una soluzione normale di NaOH. (Al riguardo si veda: titolazione di una soluzione di HCl con NaOH).
Usi dell'acido cloridrico
Il cloruro d'idrogeno e le sue soluzioni acquose trovano vasta applicazione nell'industria chimica.
Principalmente sono usati nella pulitura dei metalli, nell'industria saccarifera, nell'industria della gomma sintetica e nella riattivazione dei pozzi di petrolio.
Notevoli quantità di acido cloridrico sono impiegate per allontanare gli ossidi dai metalli che devono essere sottoposti a galvanostegia, per la disincrostazione delle cacaldaie, come catalizzatore nella produzione di glucosio dall'amido, nella preparazione del glutammato monosodico e nella preparazione del cloruro di vinile.
In minore quantità è HCl usato:
- per la preparazione del cloro;
- per la preparazione dei cloruri metallici e del cloruro di ammonio;
- per la riattivazione del carbone d'ossa;
- per la preparazione di altri composti, per esempio, solfuro di idrogeno ed biossido di carbonica;
- per la depurazione di sabbia ed argilla;
- per decomporre i saponi calcarei;
- come agente neutralizzante;
- come agente idrolizzante dei carboidrati;
- come catalizzatore nelle sintesi organiche;
- come reattivo analitico;
- per la produzione di cloruri alchilici dalle olefine;
- nella preparazione dei cloruri dagli alcoli;
- nella preparazione dei cloridrati delle ammine, degli acidi aconitico, adipico e citrico;
- nella idroclorurazione del caucciù;
- nella preparazione del silicagel;
- nella preparazione dei coloranti;
- nell'industria del cuoio;
- assieme al ferro, come agente riducente dei nitroderivati aromatici;
- per la diazotazione di basi aromatiche;
- nella preparazione dell'acido fosforico.
Link correlati:
L'HCl è un acido forte o un acido debole?
Quanto vale la massa molare dell'HCl?
Che cos'è un acido monoprotico?
Studia con noi