Permanganato di potassio
Proprietà e caratteristiche del permanganato di potassio
Il permanganato di potassio (KMnO4) è un importante composto del manganese, essendo insostituibile in numerosi processi.
Forma cristalli rombici, rosso-violacei, di sapore leggermente astringente; in acqua forma una soluzione violacea.
Per riscaldamento al di sopra di 240 °C, il permanganato libera ossigeno:
2KMnO4 → K2MnO4 + MnO2(s) + O2
A contatto con sostanze organiche esplode facilmente.
Il permanganato di potassio è un agente ossidante, assai usato nelle titolazioni di ossidoriduzione nelle quali reagisce in modo diverso a seconda che l'ossidazione avvenga in ambiente acido (caso più frequente), neutro o alcalino.
Ambiente molto acido:
MnO4− + 8 H3O+ + 5 e− ⇄ Mn2+ + 12 H2O
Ambiente circa neutro:
MnO4− + 4 H3O+ + 3 e− ⇄ MnO2 + 6 H2O
Ambiente molto alcalino:
MnO4− + e− ⇄ MnO42−
Il permanganato di potassio è pertanto usato per le titolazioni redox (permanganometria) e viene di norma impiegato in ambiente acido; in queste condizioni infatti KMnO4 ha elevato potere ossidante e presenta il vantaggio che nella riduzione MnO4− → Mn2+ corrisponde un assai netto viraggio di colore della soluzione (viola MnO4− e praticamente incolore Mn2+) che indica la fine della titolazione; per tali titolazioni quindi non è richiesto l'uso di indicatori redox, perché è lo stesso titolante che funge da indicatore.
In ambiente neutro o alcalino, invece, non solo KMnO4 è meno ossidante ma il diossido di manganese (MnO2) che si forma, nero e insolubile, rende meno netto l'apprezzamento della fine della titolazione (cioè del viraggio).

Permanganato di potassio
Il permanganato di potassio deve essere maneggiato indossando un camice da laboratorio e guanti in lattice.
Ciò è dovuto non solo alla sua tossicità, ma anche al fatto che a contatto con la pelle il KMnO4 lascia persistenti macchie scure di biossido di manganese, che possono essere eliminate strofinando la macchia con un panno imbevuto di una soluzione leggermente acida e diluita di solfito di sodio (o bisolfito di sodio).
Il permanganato di potassio deve essere conservato in bottiglie scure, al riparo della luce e in ambienti privi di umidità.
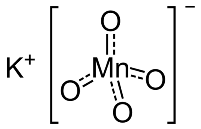
Struttura del permanganato di potassio
Il KMnO4 è un sale formato dagli ioni K+ e MnO4−.
Usi del permanganato di potassio
Gli usi del permanganato di potassio si basano essenzialmente sul suo potere ossidante.
Trova applicazioni nella preparazione di saccarina e di acido benzoico, nella sbianca dei tessuti, nella decolorazione degli olii eterei, cere e sostanze grasse; serve anche come decolorante e disinfettante.
Studia con noi