Silice
Caratteristiche e proprietà della silice
La silice (anidride silicica o diossido di silicio) è un solido covalente con formula chimica (SiO2)n.
Nello stato cristallino della silice ogni atomo di silicio è legato tetraedricamente a 4 atomi di ossigeno, ed ogni atomo di ossigeno è legato a due atomi di silicio.
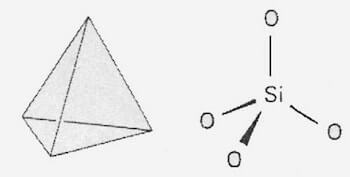
L'elevata energia del legame Si-O fa sì che la silice abbia temperatura di fusione piuttosto elevata (1710 °C) e sia chimicamente inerte (reagisce soltanto con F2, HF e con basi forti a caldo).
Si noti che CO2 solido (ghiaccio secco) fonde alla temperatura di -56,6°C mentre SiO2 fonde a 1710°C; questa grande differenza tra le temperature di fusione esprime il fatto che nella CO2 solida esistono molecole di CO2 singole, legate fra loro da modestissime forze di van der Waals, mentre nell'SiO2 solido esiste un unico reticolo cristallino che lega atomi Si ad atomi O con forti legami covalenti formando un'unica molecola gigante (SiO2)n.
Alla base di questo comportamento sta il fatto che mentre l'atomo C forma doppi legami con l'atomo O (O=C=O), e quindi CO2 solido è costituito da molecole singole CO2, ciò non è possibile per l'atomo Si; questo perché, per le sue maggiori dimensioni atomiche, è stericamente impedito a formare doppi legami e di conseguenza l'atomo Si dà sempre e solo 4 legami semplici, tetraedrici.
Ciò appunto comporta nel caso di SiO2 l'esistenza di un unico cristallo (SiO2)n.

Struttura cristallina della silice
La silice pura esiste in due forme cristalline certe: quarzo e cristobalite. Il quarzo, riscaldato si trasforma lentamente (fra circa 900 e 1400 °C) in cristobalite, che poi fonde a 1710°C.
Le strutture cristalline del quarzo e della cristobalite sono diverse: la struttura cristallina del quarzo è costituita da fasci di tetraedri (SiO4) disposti ad elica; quella della cristobalite è simile a quella del diamante (si veda: struttura del diamante) con i nodi reticolari occupati alternativamente, nelle tre direzioni dello spazio, da atomi di Si e atomi di O.
Se si raffredda rapidamente la silice fusa, si ottiene una silice vetrosa che viene impropriamente chiamata anch'essa quarzo, che può essere lattescente per minuscole bollicine d'aria inglobate e che è assai usata, per la sua inerzia chimica e per il basso coefficiente di dilatazione, nella fabbricazione di apparecchiature da laboratorio.
Preparazione della silice
La silice è ampiamente diffusa in natura in varie modificazioni: macrocristalline (quarzo), micro- e criptocristalline (calcedonio, diaspro), colloidi (opale).
La silice può essere preparata per idrolisi di SiF4, ottenendo contemporaneamente acido fluorosilicico (H2SiF6) secondo la seguente reazione chimica:
3 SiF4 + 2 H2O → 2 H2SiF6 + SiO2↓
La silice che precipita, per le ragioni precedentemente viste non è però monomera e dà luogo ad aggruppamenti di un gran numero di molecole.
Studia con noi