Acido solforico
Proprietà e caratteristiche dell'acido solforico. Vendita acido solforico
L'acido solforico è un acido ternario con formula chimica H2SO4; è un liquido incolore e inodore, di consistenza oleosa, che a contatto con la pelle può causare gravi ustioni. In soluzione acquosa altamente concentrata (> 90%) è noto come "vetriolo".
Le soluzioni costituite da triossido di zolfo (o anidride solforica, SO3) in acido solforico anidro sono note invece con il nome di Oleum (acido solforico fumante).
L'acido solforico è uno dei pochi composti preparati artificialmente noti sin dall'antichità; con lo sviluppo industriale è diventato, nel periodo moderno, uno dei prodotti basilari della grande industria chimica. Fino a qualche decennio fa la produzione di questo composto si poteva assumere come un indice sicuro del grado di sviluppo industriale di un paese: attualmente lo sfruttamento chimico del petrolio e dei gas combustibili naturali ne hanno limitato l'importanza.
L'acido solforico si trova libero in natura, particolarmente nelle acque di alcuni fiumi e torrenti in vicinanza di regioni vulcaniche. In talune sorgenti può raggiungere anche la concentrazione di alcune unità per 100; si è osservata anche la sua presenza allo stato libero in alcuni molluschi (Dolium galea).
L'acido solforico si forma anche per ossidazione lenta dello zolfo umido all'aria, ossidazione favorita dalla luce solare e da alcuni microbi aerobici. Anche i solfuri metallici naturali, come le piriti, possono dare acido solforico per lenta ossidazione all'aria.
Messo a contatto con carta, tela e sostanze simili l'acido solforico le distrugge rapidamente. Le sostanze organiche vengono carbonizzate; ciò si deve alla grande tendenza dell'acido solforico a combinarsi con l'acqua.

Effetto dell'acido solforico su un pezzetto di cotone
Struttura a puntini di Lewis dell'acido solforico
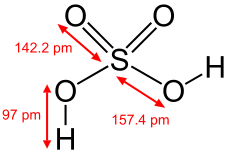
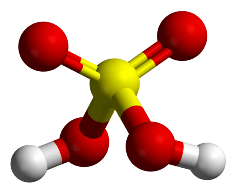
Struttura 3D
Proprietà chimiche dell'acido solforico
L'acido solforico è un acido diprotico che può portare alla formazione di due serie di sali: sali acidi MHSO4 e sali neutri M2SO4.
È un acido forte con un elevato calore di neutralizzazione:
½ H2SO4(aq) + NaOH(conc) → ½ Na2SO4(aq) + H2O + 16,949 cal
Sciogliendo in acqua l'acido solforico si ha un forte sviluppo di calore poiché si formano alcuni idrati con reazione esotermica:
H2SO4 + H2O → H2SO4 · H2O + 6,6 Kcal
H2SO4 + 2 H2O → H2SO4 · 2 H2O + 10,1 Kcal
H2SO4 + 4 H2O → H2SO4 · 4 H2O + 17,1 Kcal
La mescolanza quindi deve avvenire con estrema cautela versando l'acido solforico nell'acqua (e non viceversa) e agitando continuamente. In questo modo l'acqua assorbe buona parte del calore sviluppatosi nella mescolanza delle due sostanze.
L'acido solforico è un energico disidratante e come tale agisce verso svariati composti organici; sposta dai loro sali molti acidi forti, come l'acido cloridrico e l'acido nitrico, mentre a caldo è spostato dall'acido fosforico, più debole ma più stabile.
I metalli, ad eccezione dell'oro e degli elementi della famiglia del platino, vengono attaccati dall'acido solforico diluito; quello concentrato non attacca il molibdeno, il tantalio, il tungsteno, il rame, il nichel, le leghe in nichel-cromo, il piombo, l'acciaio.
L'acido solforico viene ridotto a caldo dai non metalli (compreso lo zolfo) con sviluppo di anidride solforosa.
Importante per l'industria è il suo comportamento con i composti organici etilenici, ai quali si addiziona a temperatura ordinaria o vicino a quella ordinaria, secondo lo schema:
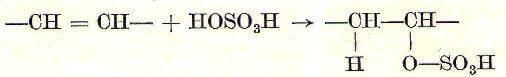
In base a questa reazione si può fissare l'etilene sotto forma di acido etilsolforico.
Per sostituzione formale di un atomo di ossigeno dell'acido solforico con un atomo di zolfo si ottiene l'acido tiosolforico H2S2O3.
pH di una soluzione di acido solforico
L'acido solforico in acqua dà soluzioni acide e quindi soluzioni con un pH < 7 (pH acido).
Per approfondimenti si veda: calcolo del pH di una soluzione di acido solforico.
Preparazione industriale dell'acido solforico
Industrialmente l'acido solforico si ottiene con due sistemi:
- metodo delle camere di piombo, che produce acido solforico di media concentrazione, metodo ormai quasi completamente abbandonato;
- metodo catalitico o di contatto, che produce acido solforico concentrato e acido solforico fumante.
Link correlati:
Bilanciamento della reazione tra H2SO4 e NaOH
Studia con noi