Ammina terziaria
Quando un'ammina si dice terziaria?
Le ammine terziarie sono composti organici che possono essere fatti derivare formalmente dall'ammoniaca (NH3) per sostituzione di tutti e tre gli atomi di idrogeno con residui alchilici o arilici.
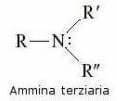
In una ammina terziaria l'atomo di azoto presenta ibridazione sp3 e geometria piramidale:
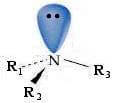
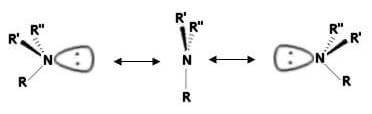
In base a questa geometria, per una ammina terziaria con gruppi diversi legati all'atomo di azoto (R1 ≠ R2 ≠ R3), si potrebbe supporre che presenti chiralità e che sia separabile nei rispettivi enantiomeri.
In realtà, le ammine di questo tipo non manifestano attività ottica in quanto i due enantiomeri si interconvertono, anche a basse temperature, molto rapidamente attraverso un movimento simile a quello di un ombrello che si rovescia per un colpo di vento:
Basicità delle ammine terziarie
In generale le ammine (così come l'ammoniaca) sono sostanze che in acqua presentano un comportamento basico.
Grazie al doppietto solitario sull'atomo di azoto, ogni ammina può infatti strappare un protone all'acqua e trasformarsi nel suo acido coniugato (R3NH+):
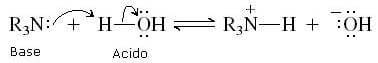
La basicità delle ammine dipende sensibilmente dai sostituenti legati all'atomo di azoto.
Le alchilammine (R—NH2) ad esempio sono più basiche dell'ammoniaca; in particolare la metilammina (CH3—NH2) è circa 22 volte più basica dell'ammoniaca.
Il gruppo metilico della metilammina è infatti un gruppo elettron-repulsore e per effetto induttivo stabilizza la carica positiva presente sull'acido coniugato (R3NH+) e sposta l'equilibrio precedente verso destra.
Le ammine secondarie sono leggermente più basiche delle ammine primarie, mentre per le ammine terziarie c'è un'inversione di tendenza e sono pertanto meno basiche delle ammine secondarie.
Il motivo di questo comportamento è da ricercarsi nell'ingombro sterico dei tre sostituenti che, tra l'altro, diminuisce anche l'effetto di solvatazione dell'acqua sullo ione alchilammonio (R3NH+), rendendolo meno stabile.
Link correlati:
Regole IUPAC per la nomenclatura delle ammine
Esercizi svolti e commentati sulle ammine
Studia con noi