pH
pH e pOH: teoria e spiegazione
Vuoi sapere che cosa sono il pH e il pOH?
Vuoi sapere quando il pH si definisce acido, neutro o basico?
Se si continua con la lettura dell'articolo.
In questa sezione infatti ci occuperemo di pH e pOH. Ma non solo .... vedremo come pH e pOH sono definiti, quale relazione matematica esiste tra pH e pOH, quando il pH si definisce acido, neutro o basico e quali valori assume la scala del pH.
Trattando soluzioni acquose, le concentrazioni degli ioni H+ e degli ioni OH− in essa presenti sono espresse da valori molto piccoli; da un punto di vista pratico è quindi conveniente utilizzare un operatore matematico che permetta di operare con numeri più semplici.
Tale operatore è il pH (si legga pi-acca).
In altre parole l'operatore pH serve a trasformare un valore molto piccolo (quello della concentrazione degli ioni H+ in soluzione acquosa) in un numero più semplice.
Stessa cosa vale per il pOH che invece trasforma in un numero più semplice la concentrazione degli ioni OH− presente nella soluzione acquosa.
Definizione di pH
Si definisce pH il logaritmo decimale negativo della concentrazione degli ioni H+:
![]()
In altre parole, per determinare il pH di una soluzione bisogna cambiare di segno (da qui il segno - presente nell'operazione) il valore del logaritmo (in base 10) della concentrazione degli ioni H+ presenti nella soluzione acquosa.
Per rendere più chiare le idee svolgiamo il seguente esercizio: si determini il pH di una soluzione la cui concentrazione [H+] è pari a 10-5 mol/L.
Svolgimento dell'esercizio
Come detto in precedenza il pH viene calcolato con la seguente formula:
pH = - log [H+]
Sostituendo il dato in nostro possesso si ha che:
pH = - log 10-5 = 5
Pertanto il pH della soluzione è 5.
Definizione di pOH
In modo del tutto analogo si può definire il pOH:
si definisce pOH il logaritmo decimale negativo della concentrazione degli ioni OH−:
![]()
In altre parole, per determinare il pOH di una soluzione bisogna cambiare di segno (da qui il segno - presente nell'operazione) il valore del logaritmo in base 10 della concentrazione degli ioni OH− presenti nella soluzione acquosa.
A 25°C essendo:
![]()
(al riguardo si veda: prodotto ionico dell'acqua):
in base alle proprietà dei logaritmi, si ha:
![]()
Pertanto la somma tra pH e pOH vale sempre 14.
Scala del pH
La scala del pH è compresa tra 0 e 14. In base al valore del pH una soluzione può essere:
Basica
Se il pH è maggiore di 7 (pH basico).
In questo caso:
[H+] < 10-7 mol/L
e
[OH−] > 10-7 mol/L
Neutra
Se il pH è uguale a 7 (pH neutro).
In questo caso:
[H+] = [OH−] = 10-7 mol/L
Acida
Se il pH è minore di 7 (pH acido).
In questo caso:
[H+] > 10-7 mol/L
e
[OH−] < 10-7 mol/L
Ma in tutti i casi valgono (a 25°C) le seguenti relazioni:
![]()
e
![]()
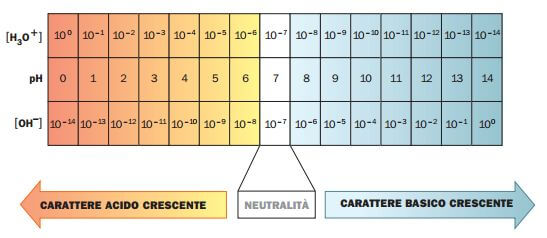
Sintetizziamo quanto detto fino ad ora nella seguente tabella:
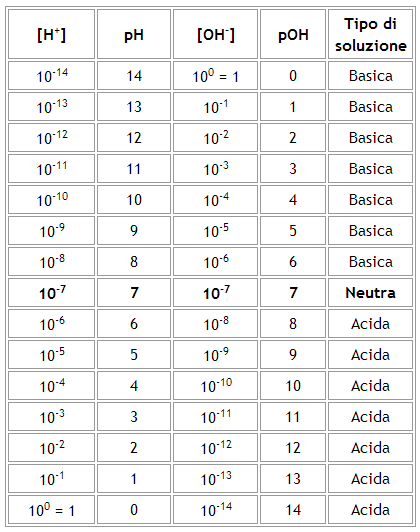
In realtà il pH può assumere anche valori superiori a 14 o negativi. Si tratta comunque di casi molto rari nei quali le concentrazioni degli ioni H+ sono eccezionalmente basse o elevate.
Il pH può essere rilevato anche con l'opportuno uso di biosensori.
Riassumendo,
il pH:
è il logaritmo decimale negativo della concentrazione degli ioni H+;
si calcola con la seguente formula: pH = - log [H+]
il pOH:
è il logaritmo decimale negativo della concentrazione degli ioni OH−;
si calcola con la seguente formula: pOH = - log [OH−]
Inoltre vale la seguente relazione:
pH + pOH = 14
Esercizio di approfondimento:
Una soluzione acquosa presenta [H+] = 10-9 mol/L.
Si determini:
il pH, il pOH e [OH−].
Svolgimento dell'esercizio
1) Calcoliamo il pH:
pH = - log [H+] = pH = - log 10-9 = 9
2) Calcoliamo il pOH:
pH + pOH = 14
Da cui:
pOH = 14 - pH = 14 - 9 = 5
3) determiniamo [OH−].
Ricordando che:
[H+] · [OH−] = 10-14
si ha che:
[OH−] = 10-14 / [H+]
da cui:
[OH−] = 10-14 / 10-9 = 10-5 mol/L
Link correlati:
Esercizi svolti e commentati sul pH
Quiz con soluzione sul pH
Come passare da pOH a concentrazione di ioni OH−
Come è possibile misurare il pH?
Quanto vale il pH dell'acqua?
Quanto vale il pH del latte?
Quanto è il pH dello stomaco?
Studia con noi