Valina
Proprietà della vanina
La valina è un amminoacido con catena laterale apolare, essa è presente nelle proteine nella configurazione L.
Il suo nome IUPAC è acido 2(S)-ammino-3-metilbutanoico e viene indicata con le sigle Val e V.
La catena laterale della valina è alifatica e corrisponde al gruppo isopropile; la sua pk1 (la costante di dissociazione acida del gruppo carbossilico) e la sua pk2 (la costante di dissociazione acida del gruppo amminico) sono rispettivamente 2,39 e 9,74. Ha un pI (punto isoelettrico) di 6.
Ha formula bruta C5H11NO2, pertanto essa ha una massa molare di 117,15 g/mol.
L-valina.
La valina si presenta come un solido cristallino biancastro, ha una solubilità in acqua pari a 85 g/L a 20 °C e la sua temperatura di fusione è 315 °C.
Funzioni biologiche della valina
La valina è un amminoacido essenziale, poiché l'organismo non è in grado di sintetizzarla, quindi deve essere assunta con la dieta.
Le principali fonti alimentari di questo amminoacido sono: pollame, latte, salmone, carne di manzo, farina, noci, piselli, spirulina (alga).
La valina è uno dei 3 amminoacidi a catena laterale ramificata (BCAA: Branched-Chain Amino Acid) insieme a leucina e isoleucina.
La valina svolge numerose funzioni all'interno dell'organismo:
- è un importante componente dei muscoli ed è fondamentale per la formazione ed il mantenimento muscolare (insieme a leucina e isoleucina costituisce un terzo delle proteine che si trovano nel muscolo; valina, leucina e isoleucina sono stati definiti amminoacidi dello stress, poiché i muscoli hanno un bisogno maggiore di questi amminoacidi durante lo stress fisico causato dall'esercizio intenso; per questo, molti atleti e bodybuilder li utilizzano).
- è coinvolta nella guarigione e nella riparazione del tessuto muscolare, delle ossa e della pelle;
- aiuta a regolare i livelli di glucosio nel sangue (glicemia);
- aumenta la sintesi di ormone della crescita;
- è coinvolta nella sintesi di proteine;
- inibisce la degradazione proteica in fegato, cistifellea e tessuto muscolare;
- è un importante componente dell'emoglobina.
Problemi nel metabolismo della valina sono molto rari, comunque alterazioni genetiche che determinano la mancanza di enzimi deputati al metabolismo di questo amminoacido (e degli altri BCAA) possono determinare la formazione di metaboliti nell'urina, che causa la cosiddetta malattia dell'urina a sciroppo d'acero (malattia genetica, caratterizzata da acidosi organica).
Il kwashiorkor (o biafra) è una forma severa di malnutrizione, causata da una dieta caratterizzata da carenza proteica per periodi più lunghi di una settimana.
La ridotta quantità di proteine (dovuta alla mancaza di amminoacidi, tra cui, soprattutto, i BCAA) causa squilibrio osmotico a livello gastrointestinale e del sistema linfatico con ritenzione idrica.
Gli specifici sintomi di carenza da valina sono perdita di equilibrio durante la locomozione e maggiore suscettibilità ad allergeni irritanti.
Livelli di valina eccessivamente elevati possono portare, come per gli altri amminoacidi, a problemi epatici e renali.
Comunque, il Ministero della Salute raccomanda una dose non superiore ai 5 g giornalieri di BCAA totali.
Applicazioni cliniche della valina
Ci sono diversi studi riguardanti le applicazioni cliniche della valina e in generale di tutti i BCAA. In particolare, essi hanno mostrato dei risultati interessanti in caso di:
- stress fisico: l'utilizzo di integratori a base di BCAA prima dell'esercizio fisico aiuta a prevenire la rottura delle proteine muscolari; da uno studio recente è emerso che gli atleti che facevano uso di BCAA, in seguito all'esercizio fisico, avevano una maggiore efficienza nel ridurre la massa grassa e nell'aumentare la massa magra rispetto a coloro che non utilizzavano gli integratori;
- patologie epatiche: è stato riscontrato che pazienti con malattie epatiche avanzate (epatite, coma epatico, cirrosi, atresia biliare extraepatica), in particolare, quelli con patologie indotte da alcolismo, presentano carenza di questi amminoacidi. Gli amminoacidi aromatici (AAA) tirosina, triptofano e fenilalanina, oltre alla metionina, sono invece aumentati in tali condizioni. Gli amminoacidi a catena laterale ramificata competono con gli amminoacidi aromatici fenilalanina, tirosina e triptofano per il trasporto nel cervello. Supplementi di amminoacidi ramificati, vitamina B6 e zinco aiutano a normalizzare il rapporto BCAA/AAA;
- SLA: in uno studio della durata di un anno, i BCAA hanno mostrato benefici in termini di mantenimento della forza muscolare in pazienti affetti da SLA, ma, secondo un altro studio, dosi elevate di BCAA hanno portato a un aumento della mortalità di pazienti soggetti a questa patologia;
- malnutrizione: in particolare, in seguito a interventi chirurgici, vengono somministrati BCAA come parte della nutrizione parenterale intravenosa al fine di ottenere l'incremento della massa muscolare. L'uso di BCAA prima e dopo l'intervento chirurgico riduce i tempi di recupero;
- discinesia tardiva, un disturbo del movimento, che è un effetto collaterale di farmaci antipsicotici come i neurolettici;
- trauma;
- ustione;
- insufficienza renale.
Biochimica della valina
La valina, come già detto, non può essere sintetizzata dall'organismo umano.
Essa subisce un metabolismo ossidativo abbastanza complesso.
Sono necessarie 7 reazioni per convertire l'amminoacido in propionil-coenzima A, la forma attivata dell'acido propionico.
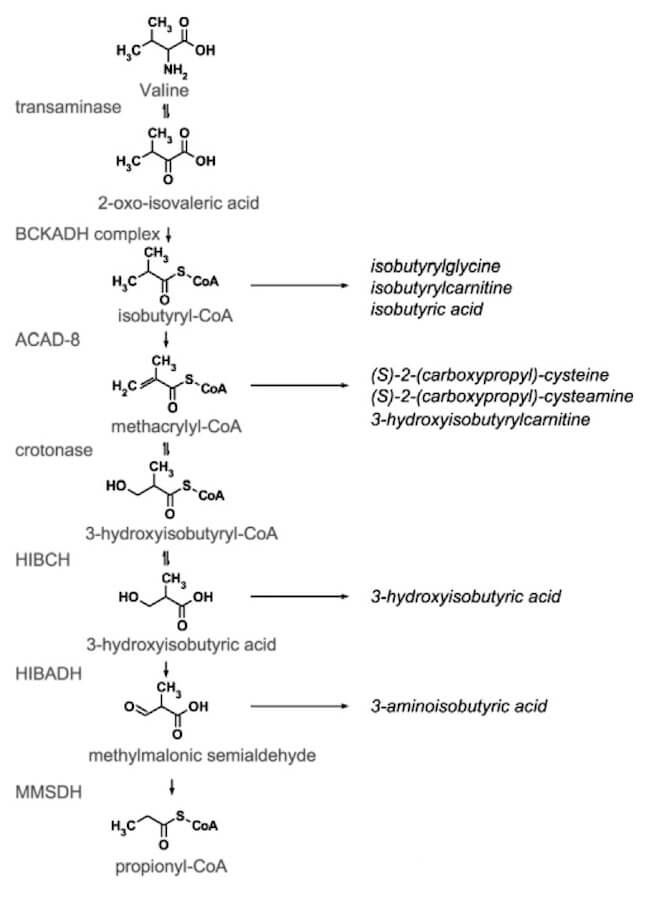
Conversione della valina in propionil-coenzima A.
Il propionil-coenzima A viene, quindi, convertito in metilmalonil-coenzima A, che è il precursore diretto del succinil-coenzima A, il quale, a sua volta, può essere convertito in glucosio. Quindi, la valina è un amminoacido glucogenico.
Durante la traduzione o sintesi proteica, l'amminoacido valina è codificato dalle triplette di nucleotidi GUC, GUU, GUA e GUG.
Studia con noi