Punto isoelettrico
Che cos'è il punto isoelettrico?
Gli amminoacidi o aminoacidi sono composti organici che contengono nella molecola sia un gruppo acido (di solito un gruppo carbossilico, -COOH) che un gruppo amminico (-NH2).
La grande maggioranza di questi amminoacidi naturali hanno il gruppo amminico legato al carbonio in α rispetto al gruppo carbossilico. Tali amminoacidi sono chiamati α-amminoacidi.
Gli α-amminoacidi presentano la seguente struttura chimica:
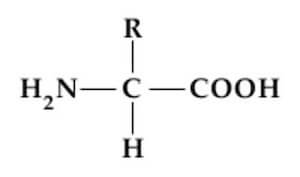
Il gruppo -R può essere un atomo di idrogeno (nella glicina), una catena alifatica (ramificata o no, sostituita o no), un anello aromatico o un anello eterociclico.
Dato che la funzione dell'acido carbossilico è acida e il gruppo amminico è basico gli amminoacidi sono sostanze anfotere.
Un amminoacido può esistere quindi in una forma completamente protonata (forma cationica) o in una forma completamente deprotonata (forma anionica). A seconda del pH della soluzione dell'amminoacido, può prevalere la forma cationica o la forma anionica dell'amminoacido.
In particolare, per pH molto acidi prevale la forma cationica, per pH molto basici prevale la forma anionica.
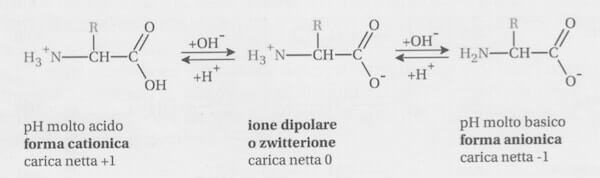
Esiste un pH al quale l'amminoacido è presente in forma di ione dipolare (zwitterione). Questo valore di pH (caratteristico per ciascun amminoacido) si chiama punto isoelettrico (o pH isoelettrico).
Se in una soluzione di un amminoacido si introducono due elettrodi aventi fra loro una differenza di potenziale elettrico, l'amminoacido può migrare all'anodo o al catodo a seconda che prevalga la forma cationica o la forma anionica dell'amminoacido e quindi a seconda del pH della soluzione.
Al punto isoelettrico pI non vi è alcuna migrazione netta di amminoacido, poiché la carica netta è uguale a zero.
Definizione di punto isoelettrico
In base a quanto detto in precedenza possiamo definire il pI nel seguente modo: il punto isoelettrico è il pH al quale un amminoacido è presente prevalentemente in forma di ione dipolare (zwitterione).
Come si calcola il punto isoelettrico
Gli amminoacidi che non hanno catene laterali ionizzabili hanno due costanti di ionizzazione con i relativi pKa di circa 2 e 9.
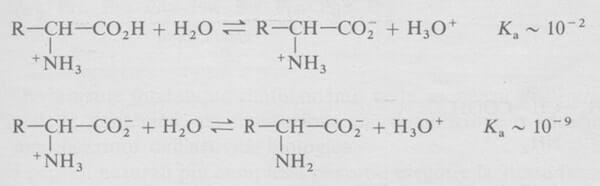
Per tutti quegli amminoacidi che non hanno gruppi ionizzabili nella loro catena laterale, il punto isoelettrico pI è dato dalla media aritmetica dei due valori di pKa.
Ad esempio, per la glicina (pK1 = 2,34 ; pK2 = 9,60) si ha che:
pI = (pK1 + pK2) / 2 = (2,34 + 9,60) / 2 = 5,97
Il punto isoelettrico varia a seconda della natura del residuo -R. Se l'amminoacido ha una sola funzione acida e una sola funzione basica (come ad esempio la glicina vista in precedenza) il punto isoelettrico è intorno a 6; il pI di amminoacidi che hanno due funzioni acide e una sola funzione basica è intorno a 3; il pI di amminoacidi che hanno due funzioni basiche e una funzione acida è invece intorno a 9.
Punto isoelettrico degli amminoacidi
Di seguito il valore del punto isoelettrico degli amminoacidi naturali:
- pH = 5,97 per la glicina;
- pH = 6,01 per la alanina;
- pH = 5,96 per la valina;
- pH = 5,98 per la leucina;
- pH = 6,02 per la isoleucina;
- pH = 5,48 per la fenilalanina;
- pH = 5,74 per la metionina;
- pH = 6,30 per la prolina;
- pH = 5,89 per il triptofano;
- pH = 5,68 per la serina;
- pH = 5,66 per la tirosina;
- pH = 5,41 per la asparagina;
- pH = 5,05 per la cisteina;
- pH = 5,65 per la glutammina;
- pH = 5,60 per la treonina;
- pH = 2,77 per l'acido aspartico;
- pH = 3,22 per l'acido glutammico;
- pH = 9,74 per la lisina;
- pH = 10,76 per l'arginina;
- pH = 7,59 per l'istidina.
Studia con noi