Solubilità e legge di Henry
Effetti della temperatura e della pressione sulla solubilità. Legge di Henry
Si definisce solubilità la massima quantità in grammi di soluto che, a una data temperatura, può essere disciolta in 100 grammi di solvente (ti potrebbe interessare: 100 grammi in mL).
La solubilità del cloruro di sodio in acqua, per esempio, è di 37 g/100 mL a 20 °C.
Ciò significa che a 20 °C in 100 mL di acqua si potranno al massimo sciogliere 35,7 g di NaCl.
Una qualsiasi soluzione che contenga una quantità di soluto inferiore alla sua solubilità a una temperatura data è detta insatura.
Quando invece tentiamo di sciogliere una sostanza in quantità maggiore rispetto di quella indicata dalla sua solubilità, una parte non si scioglie e si deposita come corpo di fondo.
La soluzione ottenuta costituisce una soluzione satura.
Se una soluzione satura a una data temperatura viene raffreddata, una parte del soluto precipita come corpo di fondo fino a che la quantità di soluto in soluzione corrisponde alla solubilità della sostanza alla nuova temperatura.
Operando il raffreddamento in maniera lenta, si può arrivare a superare il limite di solubilità senza che si verifichi alcuna precipitazione.
In questo caso il sistema si trova in equilibrio instabile e la quantità di soluto in soluzione è maggiore di quella consentita dalla solubilità alla nuova temperatura; in queste condizioni la soluzione è sovrasatura.
Un piccolo colpo al contenitore o l'introduzione di un minuscolo cristallo di soluto provoca però l'immediata cristallizzazione di tutta la quantità in eccesso.
Il processo di solubilizzazione può essere sia esotermico che endotermico.
Effetti della temperatura sulla solubilita'
La solubilità dei solidi nei liquidi è fortemente influenzata dalla temperatura e in genere aumenta all'aumentare di quest'ultima. In alcuni rari casi, la solubilità diminuisce all'aumentare della temperatura.
Ne sono esempio il carbonato di litio Li2CO3 e il solfato di cesio Ce2(SO4)3. Nel caso del solfato di calcio CaSO4 la solubilità è indifferente all'aumento di temperatura.
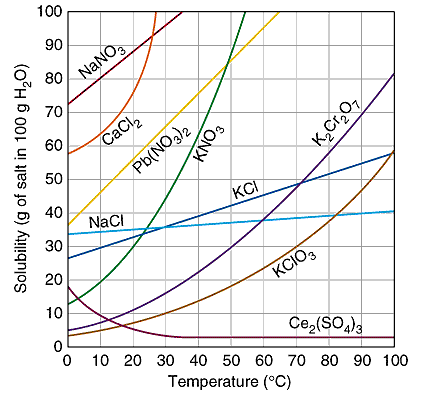
Solubilità di alcune sostanze al variare della temperatura.
La solubilità dei gas nei liquidi diminuisce all'aumentare della temperatura.
Effetti della pressione sulla solubilita' (legge di Henry)
Poiché i solidi ed i liquidi sono praticamente incomprimibili la solubilità non è influenzata dalla variazione della pressione.
Diverso è il caso di soluti gassosi. In questi casi vale la legge di Henry: a temperatrura costante la quantità di un gas poco solubile disciolta in un dato volume di liquido è proporzionale alla pressione (p) del gas nella fase gassosa sovrastante la soluzione.
Indicando con c la concentrazione del gas nella soluzione e con p la sua pressione nella fase gassosa sovrastante, la legge di Henry è espressa dalla seguente relazione:
![]()
nella quale k è la costante di Henry il cui valore dipende sia dalla natura chimica del soluto che del solvente.
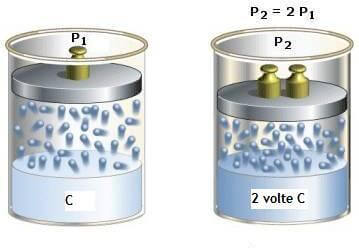
Non ci soffermiamo sul caso di gas molto solubili nel liquido, per i quali la dipendenza della solubilità del gas dalla pressione non è esprimibile con formule generali a causa della varietà e della complessità delle interazioni gas-solvente.
Studia con noi