Glucosio
Proprietà e caratteristiche del glucosio
Il glucosio, noto anche con il nome di destrosio, è un monosaccaride a sei atomi di carbonio.
Si presenta come un solido cristallino bianco; è un aldoso molto abbondante in natura e lo si ritrova sia libero che sotto forma di polimeri.
La formula chimica del glucosio è la seguente: C6H12O6. Ha massa molare di 180,16 g/mol e densità di 1,54 g/cm3.
Struttura del glucosio
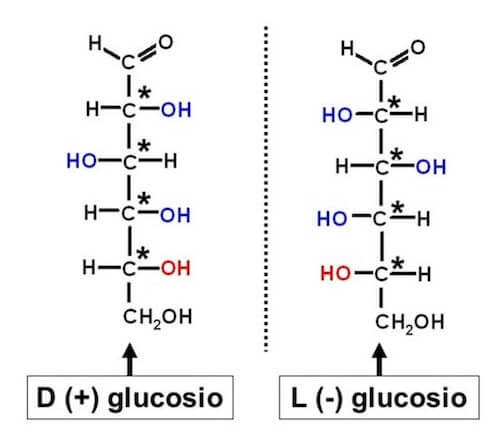
Il glucosio è presente sia come D-glucosio che come L-glucosio (che risultano enantiomeri), a seconda della posizione del gruppo -OH legato al C-5 rispetto a quella della D- o L-gliceraldeide.
Il glucosio esiste in una struttura aperta in equilibrio con due strutture cicliche piranosidiche a sei atomi.
Tali strutture sono dovute alla formazione di un emiacetale ciclico per reazione intramolecolare del gruppo aldeidico con il gruppo ossidrilico in posizione 5.
Per esempio, il D-glucosio chiude un anello formando un emiacetale e solo una piccola quantità di forma aldeidica libera rimane in equilibrio con la forma emiacetalica in soluzione.
Occorre osservare che la chiusura dell'anello converte il carbonio aldeidico in un carbonio asimmetrico, pertanto si avranno 2 emiacetali in soluzione acquosa, in equilibrio con l'adeide.
Tali emiacetali sono designati con le lettere α e ß:
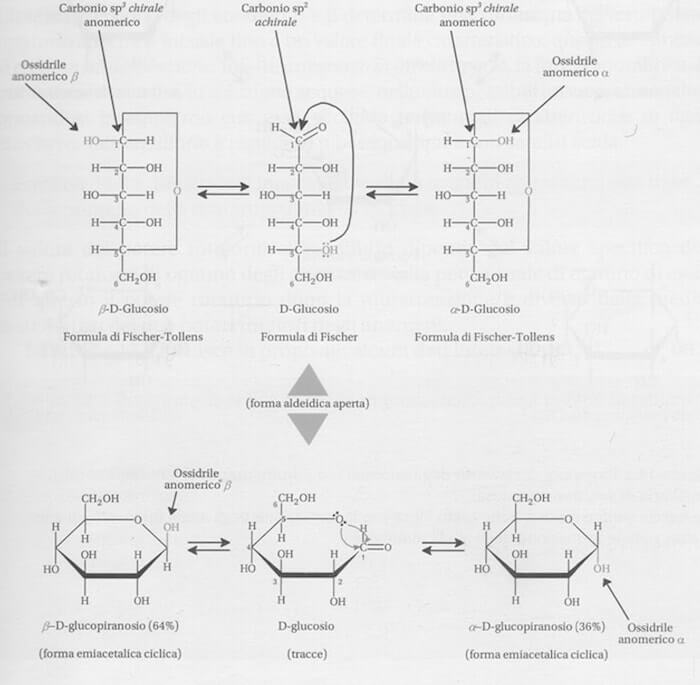
La più stabile tra le due strutture è quella ß in quanto esiste in una conformazione a sedia nella quale tutti i gruppi -OH sono in posizione alternata (equatoriale).
Le due forme isomere α e ß hanno rispettivamente punti di fusione di 146°C e 150°C e poteri rotatori specifici di +112° e +19°.
Da una soluzione acquosa di solo α-glucosio o di solo ß-glucosio si raggiunge un equilibrio chimico tra le due forme allo stabilirsi del quale il potere rotatorio specifico della soluzione raggiunge il valore di +52,7°. Ciò avviene in seguito al fenomeno della mutarotazione.
Oltre alle sopracitate strutture piranosidiche del D-glucosio sono possibili, anche se meno frequenti, strutture furanosidiche nelle quali è presente un anello eterociclico a 5 atomi anziché a 6.
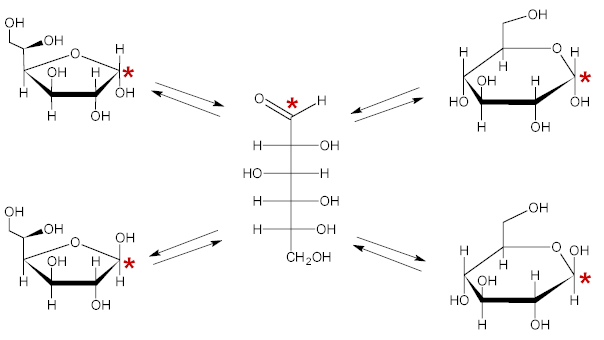
Forme cicliche del D-glucosio.
A sinistra le forme furanosidiche e a destra le forme piranosidiche.
Proprietà chimiche del glucosio
Il comportamento chimico del glucosio può essere così riassunto:
- riduce il reattivo di Fehling;
- reagisce con idrossilammina formando una ossima;
- reagisce con fenilidrazina dando l'osazone corrispondente;
- reagendo con metanolo in presenza di acido cloridrico porta alla formazione di α e ß- metil glucosidi.
- sottostà a molti processi di fermentazione.
Preparazione del glucosio
La preparazione industriale del glucosio prevede l'idrolisi dell'amido. Tale reazione chimica viene condotta in presenza di acido solforico a caldo e in autoclave alla temperatura di 110°C.
Dopo purificazione con carbone attivo, la soluzione viene concentrata e posta in commercio come sciroppo.
Per cristallizzazione della soluzione così preparata si può ottenere invece il glucosio allo stato solido cristallino.
Importanza del glucosio
Il glucosio riveste un ruolo fondamentale in tutti in tutti gli organismi viventi del mondo vegetale e animale in quanto è in essi presente sia in forma libera che combinata (saccarosio, lattosio, amido, cellulosa, glicogeno).
Nel metabolismo degli animali riveste un ruolo essenziale come fonte di energia (per info si veda: glicolisi).
Nell'uomo il tenore di glucosio nel sangue deve rientrare in determinati parametri e a tal fine - la sua concentrazione - è controllata dall'insulina.
Link correlati:
Caratteristiche e proprietà della dulcina
Che cos' il ciclammato di sodio?
Il ciclo dei pentosio fosfato e il suo ruolo metabolico
Studia con noi