Treonina
Proprietà e caratteristiche della treonina
La treonina è un amminoacido con catena laterale polare, essa è presente nelle proteine nella configurazione L.
Il suo nome IUPAC è acido 2(S)-ammino-3(R)-idrossibutanoico, ma è nota anche come acido α-amminico-β-idrossibutirrico, e viene indicata con le sigle Thr e T.
La catena laterale della treonina contiene un gruppo idrossile; la sua pk1 (la costante di dissociazione acida del gruppo carbossilico) e la sua pk2 (la costante di dissociazione acida del gruppo amminico) sono rispettivamente 2,09 e 9,1.
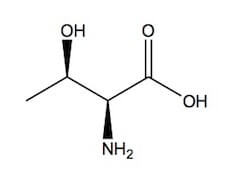
L-treonina.
La treonina ha un pI (punto isoelettrico) di 5,6. La sua formula bruta è C4H9NO3, pertanto essa ha una massa molare di 119,12 g/mol.
La treonina si presenta come un solido cristallino bianco, ha una solubilità in acqua pari a 200 g/L a temperatura ambiente e la sua temperatura di fusione è 255 °C.
Funzioni biologiche della treonina
La treonina è un amminoacido essenziale, poiché l'organismo non è in grado di sintetizzarla, quindi deve essere assunta con la dieta.
Le principali fonti alimentari di questo amminoacido sono: spirulina (alga), stoccafisso, lievito, soia, latte, pancetta, pollame, vitello, coniglio, lupini.
La treonina svolge numerose funzioni all'interno dell'organismo:
- è un importante costituente di diverse proteine dei tessuti connettivi, come il collagene, l'elastina, le proteine dello smalto dentale;
- si trova anche nel sistema nervoso centrale;
- si trova nelle proteine che costituiscono il muscolo scheletrico e il cuore;
- migliora la produzione di anticorpi;
- è necessaria per la formazione degli amminoacidi glicina e serina;
- agisce da fattore lipotropico, controllando l'accumulo di grassi nel fegato;
- funge da trasportatore dei gruppi fosfato delle proteine: nel processo di regolazione di attività della proteina, essa viene fosforilata dagli enzimi appartenenti alla classe delle chinasi a livello della catena laterale dei residui di treonina;
- è coinvolta nel metabolismo dei neurotrasmettitori acetilcolina, colina e delle catecolammine (adrenalina, noradrenalina, dopamina);
- è utile nel metabolismo epatico delle sostanze di scarto;
- svolge un ruolo importante nel metabolismo della creatina;
- favorisce il metabolismo della vitamina B12 (cobalamina).
Coloro che seguono una dieta strettamente vegetariana sono ad alto rischio di carenza di treonina. Comunque, carenze di questo amminoacido sono possibili anche con una dieta non vegetariana.
Alcune cause di carenza di treonina, oltre al tipo di dieta, sono:
- stress;
- infezioni;
- scarso assorbimento;
- utilizzo di supplementi di metionina;
- età.
Possono insorgere vari problemi in seguito a scarsi livelli di treonina nell'organismo, a causa del suo coinvolgimento in numerosi processi metabolici.
I sintomi da carenza di treonina includono:
- disfunzioni neurologiche;
- problemi alla pelle;
- debolezza;
- irritabilità;
- ipoglicemia (ridotta concentrazione di glucosio nel sangue), in particolare se sono bassi anche i livelli di glicina e serina;
- accumulo di grassi nel fegato.
Sono stati riscontrati livelli di treonina inferiori alla norma anche in pazienti con cancro del pancreas.
Gli integratori a base di treonina, in genere, non presentano una particolare tossicità, quindi sono prodotti abbastanza sicuri.
Comunque, livelli di treonina eccessivamente elevati possono portare, come per gli altri amminoacidi, a problemi epatici e renali.
Inoltre, da un recente studio, è emerso che l'uso di integratori di treonina è associato all'ipertensione.
Applicazioni cliniche della treonina
Ci sono diversi studi riguardanti le applicazioni cliniche della treonina.
Essa si è rivelata utile per:
- SLA (sclerosi laterale amiotrofica): la treonina si è dimostrata utile nel contrastare alcuni sintomi della SLA;
- depressione: scarsi livelli di treonina e alcuni altri amminoacidi sono associati alla depressione;
- aumento delle difese immunitarie: uno studio ha notato un aumento del peso del timo, la ghiandola che permette la maturazione dei linfociti T, in seguito all'integrazione di treonina; questo ha suggerito che gli effetti della treonina erano dovuti a una specifica richiesta dell'amminoacido da parte dell'organo;
- sclerosi multipla: la treonina si è rivelata efficace nel migliorare l'inibizione postsinaptica glicinergica dell'arco motorio riflesso nel midollo spirale; la somministrazione di treonina può, quindi, rappresentare un approccio non tossico e non sedativo alla gestione della spasticità nella sclerosi multipla, con dosaggi tra i 3 e i 6 grammi al giorno.
Biochimica della treonina
La treonina, come già detto, non può essere sintetizzata dall'organismo umano.
Essa è il precursore della glicina e della serina (che viene formata a partire dalla glicina).
La formazione della glicina a partire dalla treonina è un processo che avviene in 2 tappe.
La treonina viene ossidata a 2-ammino-3-chetobutirrato, in una reazione catalizzata dalla treonina deidrogenasi, che utilizza NAD+ come cofattore.
Quindi, il 2-ammino-3-chetobutirrato, reagendo con il coenzima A, viene convertito in glicina.
Questa reazione è catalizzata dall'enzima 2-ammino-3-chetobutirrato coenzima A ligasi e porta anche alla formazione di acetil-coenzima A.
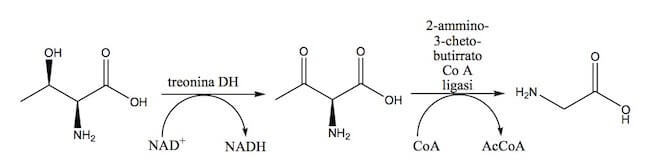
Biosintesi della glicina in due tappe.
La treonina è considerata un amminoacido sia glucogenico sia chetogenico.
Infatti, essa può essere convertita, con una lunga sequenza di reazioni biochimiche, in piruvato, il quale può, quindi, essere convertito in glucosio (glucogenico).
Inoltre, la treonina può essere convertita in acetil-coenzima A, che può entrare nel ciclo di Krebs, il processo fondamentale per il metabolismo energetico, oppure può portare alla sintesi dei corpi chetonici (chetogenico).
Durante la traduzione o sintesi proteica, l'amminoacido treonina è codificato dalle triplette di nucleotidi ACC, ACT, ACA e ACG.
Studia con noi