Acido fluoridrico
Proprietà e caratteristiche dell'acido fluoridrico
L'acido fluoridrico è un acido binario con formula chimica HF.
A temperatura e pressione ambiente è un gas incolore (in questo caso si parla di fluoruro di idrogeno), estremamente velenoso.
C. W. Scheele studiò per primo, nel 1771, il fluoruro di idrogeno ottenuto per azione dell'acido solforico sulla fluorite; tale gas era già noto per la proprietà di attaccare il vetro.
La purificazione e la determinazione della vera natura di questa sostanza furono oggetto di numerose ricerche.
Gay-Lussac e Thènard ne fecero nel 1809 uno studio assai dettagliato in base al quale A. M. Ampère formulò l'ipotesi che si trattasse di un composto contenente idrogeno e fluoro ma privo di ossigeno.
E. Fremy, nel 1856, preparò per primo il fluoruro d'idrogeno allo stato anidro scaldando idrogenodifluoruro di potassio, KHF2.
Proprietà del fluoruro di idrogeno
Il fluoruro di idrogeno allo stato anidro è dissociato solo in tracce per cui non presenta carattere acido. Solo in soluzione acquosa presenta un debole carattere acido. La sua costante di dissociazione acida è Ka = 3,5 · 10-4. La forza dell'acido fluoridrico è quindi vicina a quella dell'acido acetico.
I sali dell'acido fluoridrico di basi forti (es. NaF) in soluzione acquosa danno idrolisi basica; inafatti, mente lo ione Na+ non dà idrolisi, lo ione F− reagisce con l'acqua nel seguente modo:
F− + H2O → HF + OH−
Le soluzioni acquose di HF hanno quindi un pH > 9 (pH basico).
Il fluoruro d'idrogeno, si scioglie in acqua in ogni rapporto. Il calore di idratazione in una soluzione molare ammonta a 4,5 kcal per ogni mole di HF.
A causa della sua grande tendenza a combinarsi con l'acqua, il fluoruro d'idrogeno agisce da disidratante per molte sostanze. Per la stessa ragione il fluoruro d'idrogeno anidro e le sue soluzioni con un tenore superiore al 70% fumano all'aria umida.
Oltre che nell'acqua, il fluoruro d'idrogeno si scioglie in ogni rapporto in molti liquidi organici, come alcooli, eteri, chetoni e nitrili ed in molti casi forma con essi composti.
Il fluoruro d'idrogeno attacca i vetri al silicato od al borato, meno facilmente quelli al fosfato ed il vetro di silice.
A temperatura ambiente quasi tutti i metalli sono stabili al fluoruro d'idrogeno anidro. La resistenza del ferro all'acido fluoridrico diminuisce col diminuire della concentrazione della soluzione acquosa fino ad un contenuto del 70% di acido fluoridrico.
Struttura a puntini di Lewis e legame ad idrogeno nel fluoruro di idrogeno
Nella molecola del fluoruro di idrogeno è presente un legame covalente fortemente polarizzato.

L'alta temperatura di ebollizione (19,5 °C) del fluoruro di idrogeno HF rispetto a quella degli altri alogenuri di idrogeno è dovuta alla presenza del legame a idrogeno.
Struttura 3D
Sicurezza nell'uso dell'acido fluoridrico
L'acido fluoridrico può venir maneggiato con relativa sicurezza, purché si prendano le precauzioni necessarie.
L'HF è estremamente corrosivo per la pelle e, secondo la sua concentrazione e la durata del contatto, si possono riportare scottature superficiali o gravi ulcerazioni, che guariscono molto lentamente (si veda figura).
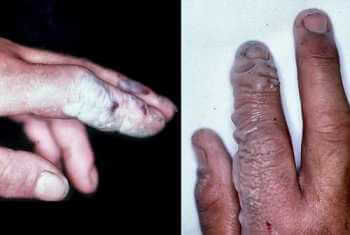
Per evitare complicazioni gravi, bisogna lavare con abbondante acqua le parti colpite, specialmente gli occhi, e quindi provvedere immediatamente ad una medicazione e a chiamare i soccorsi.
La respirazione di vapori di fluoruro d'idrogeno può causare un edema polmonare.
L'HF, fin da principio, provoca una forte irritazione agli occhi ed all'apparato respiratorio, così da mettere in allarme; le dosi mortali si dovrebbero quindi respirare quando si è già in stato di incoscienza.
Quando si lavora con fluoruro d'idrogeno è necessario munirsi di abiti protettivi, di maschere, e di occhiali protettivi.
Preparazione del fluoruro di idrogeno
In laboratorio il fluoruro d'idrogeno anidro si può preparare per riscaldamento dell'idrogenofluoruro di potassio in apparecchi costruiti in metalli nobili.
Industrialmente l'acido fluoridrico viene ottenuto per attacco della fluorite con acido solforico:
CaF2 + H2SO4 → 2 HF + CaSO4
La fluorite usata deve contenere almeno il 97-98% di CaF2 e non più dell'1% di silice: per purificarla si usano i processi di flottazione.
Usi dell'acido fluoridrico
Numerose applicazioni del fluoruro d'idrogeno dipendono dalla sua capacità di sciogliere i silicati.
Uno degli esempi più antichi a questo proposito è quello dell'attacco del vetro. Mentre per incisioni trasparenti viene usato il fluoruro d'idrogeno da solo, per incisioni opache servono miscele dello stesso con fluoruri alcalini e d'ammonio.
Quantità notevoli di HF vengono usate per eliminare i residui di sabbia dei getti di fusione e come mordente per pezzi metallici.
Per il loro potere disinfettante, il fluoruro d'idrogeno e altri fluoruri vengono usati nell'industria delle fermentazioni per arrestare determinate fermentazioni non desiderate. Questo impiego però non si è potuto generalizzare nella pratica perché poi i prodotti secondari della fermentazione, per esempio fermenti e residui, non si possono più usare come mangimi a causa del loro contenuto in fluoro.
Una buona parte dell'acido fluoridrico viene inoltre impiegata nell'industria chimica per ulteriori lavorazioni; l'acido acquoso praticamente viene tutto assorbito dal settore inorganico per la preparazione dei fluoruri e della criolite sintetica.
L'acido anidro è stato ampiamente utilizzato in passato nell'industria organica anzitutto per ottenere composti fluororganici, dei quali sono da citare, come i più importanti: i clorofluorometani (frigen, freon) usati nelle macchine frigorifere, solventi, propellenti e insetticidi.
L'acido fluoridrico viene altresì adoperato come catalizzatore per la saccarificazione del legno. Qui si trova in concorrenza con l'acido cloridrico, sul quale però presenta alcuni vantaggi.
Un uso relativamente recente dell'acido fluoridrico è la preparazione di esafluoruro di uranio, che serve per separare e concentrare alcuni isotopi dell'uranio interessanti per l'utilizzazione dell'energia atomica.
L'HF anidro viene conservato e manipolato in recipienti di ferro.
Per l'HF in soluzione occorrono contenitori di Pb o grafite.
Link correlati:
Che cos'è l'esafluoruro di zolfo?
Studia con noi