Grafite
Struttura della grafite e principali proprietà fisiche e chimiche
L'atomo di carbonio esiste in tre forme allotropiche: diamante, grafite e fullerene.
Tra diamante e grafite, la forma termodinamicamente stabile è la grafite (ΔG°f,grafite = 0,00 kJ/mol ; ΔG°f,diamante = 2,9 kJ/mol).
Il diamante, per la lentezza della trasformazione diamante → grafite, termodinamicamente spontanea, è cineticamente stabile.
La grafite è un minerale che si presenta in cristalli tabulari a contorno esagonale o, più spesso, in masse lamellari, grigio-nere con lucentezza metallica, untuose al tatto. Ha durezza 1 e densità 2,2 g/cm3.
Si trova in rocce di metamorfismo termico regionale, come calcari cristallini, scisti o gneiss, derivate dalla trasformazione di preesistete materiale organico.
La grafite può anche essere prodotta artificialmente dal carbon coke che, dopo alcuni trattamenti preliminari, viene riscaldato in forni elettrici a temperatura di 2500°C.
Struttura della grafite
Nella grafite gli atomi di carbonio sono legati fra loro mediante orbitali ibridizzati sp2, che sono planari e a 120° l'uno dall'altro.
L'orbitale p non coinvolto nell'ibridazione si dispone perpendicolarmente al piano formato dai tre orbitali ibridi sp2.
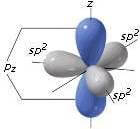
Una tale situazione dà luogo ad una struttura esagonale che si sviluppa su piani e non nello spazio, come avviene invece nel diamante in cui la ibridizzazione sp3 degli orbitali dell'atomo C dà luogo ad una struttura tetraedrica, più compatta - densità 3,51 g/cm3 contro 2,22 g/cm3 per la grafite - (si veda: struttura del diamante).
Nei piani che costituiscono il cristallo di grafite, gli atomi C, ibridizzati sp2, possiedono un quarto elettrone su un orbitale p non ibridizzato e perpendicolare al piano stesso; questi orbitali si ricoprono fra loro formando un orbitale delocalizzato su tutto il piano.
La notevole distanza fra i piani pari a 0,340 nm, indica che la ricopertura fra gli orbitali delocalizzati dei diversi piani è trascurabile, e che fra essi esistono praticamente solo forze di Van der Waals.

Struttura della grafite
Principali proprietà fisiche e chimiche della grafite
Cristalli perfetti di grafite, sono altrettanto rari che diamanti perfetti delle stesse dimensioni.
La struttura descritta in precedenza spiega le proprietà lubrificanti della grafite, perché i piani, debolmente legati fra loro, possono facilmente scorrere l'uno sull'altro, e ne spiegano altresì la conducibilità elettrica, di tipo metallico, dovuta agli elettroni delocalizzati su tutto il cristallo; la resistenza elettrica della grafite è anisotropa ed è minima (ρ = 1,4 · 10-3 Ω·cm) parallelamente ai piani e circa 100 volte maggiore perpendicolarmente ad essi.
La grafite dà luogo anche a composti interstiziali, in cui atomi di vari elementi (ad esempio dei metalli alcalini) vanno ad interporsi con regolarità geometrica fra i piani che costituiscono il cristallo di grafite, allontanandoli fra loro.
A proposito delle proprietà lubrificanti: lo studio del fenomeno portò alla conclusione che tali proprietà sono dovute anche alla presenza fra i piani cristallini della grafite stessa di molecole delle specie gassose che costituiscono l'aria, trattenute da legami di van der Waals, che costituiscono cuscinetti di scorrimento fra tali piani.
Alla diminuzione del numero di dette molecole corrisponde un proporzionato scadimento delle proprietà lubrificanti della grafite, un maggior attrito, e un conseguente più rapido consumo di questa.
Link correlati:
Che cos'è il diamante sintetico?
In cristallografia che cosa si intende per geminazione?
Studia con noi