Metalli
Generalità e proprietà dei metalli
Si definiscono metalli quegli elementi chimici della tavola periodica che formano ossidi basici e reagiscono con gli acidi dando sali.
Oltre a queste proprietà chimiche i metalli sono caratterizzati da elevata malleabilità (capacità di ridursi in lamine) e duttilità (capacità di ridursi in fili sottili), elevato potere riflettente (in un intervallo di frequenza ampio che comprende il visibile), buona conducibilità termica e conducibilità elettrica molto maggiore di quella dei cristalli di elementi non metallici. Inoltre i metalli tipici presentano strutture cristalline a elevata simmetria e compattezza.
I metalli, situati a sinistra della tavola periodica, sono gli elementi chimici più numerosi (più di 80) e a temperatura ambiente e pressione ambiente sono tutti quanti solidi tranne il mercurio che è un liquido.
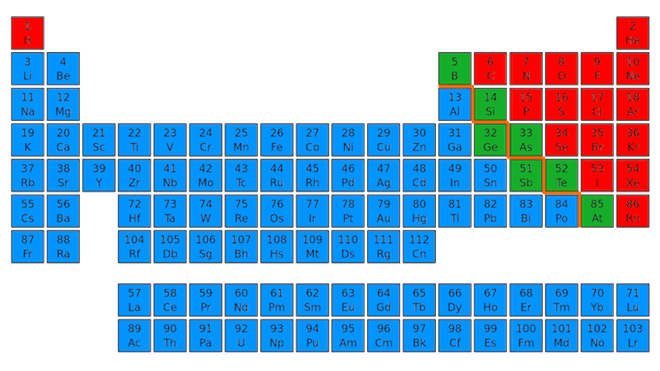
In blu i metalli della tavola periodica.
Elementi metallici di uso comune sono l'oro, l'argento, il ferro, il rame, l'alluminio e il titanio.
Gli elementi metallici danno luogo alla serie basica dei composti; infatti reagendo con l'ossigeno formano gli ossidi basici che, a loro volta reagendo con l'acqua formano gli idrossidi.
Serie basica:
Metallo + O2 → Ossido (basico);
Ossido (basico) + H2O → Idrossido (base)
Di seguito vengono riassunte le principali proprietà dei metalli:
- Stato fisico: solido (tranne il mercurio)
- Aspetto: metallico, lucente
- Flessibilità: malleabile, duttile
- Conducibilità termica: elevata
- Conducibilità elettrica: elevata
- Densità: elevata
- Punto di fusione: elevato
- Reattività chimica: reagisce con i non metalli
Discorso opposto meritano i non metalli che danno luogo invece alla serie acida dei composti.
Molte proprietà chimiche dei metalli dipendono dalla loro tendenza a perdere facilmente elettroni, tendenza particolarmente spiccata nei metalli alcalini e alcalino-terrosi. Per quanto riguarda le proprietà fisiche esse dipendono dal singolare legame presente nei metalli che viene appunto chiamato legame metallico, descritto più avanti.
Carattere metallico e struttura elettronica
È caratteristica peculiare dei metalli che la loro conducibilità elettrica risulti tanto maggiore quanto più puro, o in generale esente da difetti reticolari, è il cristallo, e più bassa la temperatura.
L'insieme delle proprietà degli elementi metallici dipende dalla presenza di elettroni liberi, ed è connesso, per quanto in modo complesso, alla struttura elettronica esterna, ovvero al numero di elettroni di valenza.
Gli elementi con un solo elettrone di valenza, quali i metalli alcalini nonché Cu, Ag e Au, presentano proprietà tipicamente metalliche. Tali proprietà si attenuano al crescere del numero di elettroni s e p negli orbitali di valenza dell'elemento, tant'è che gli elementi con sei o sette elettroni negli orbitali esterni hanno tipici caratteri non-metalli quali O, S, CI.
Si noti che l'occupazione degli orbitali d dà luogo alla serie dei metalli di transizione. Questi elementi presentano carattere spiccatamente metallico e grande importanza tecnologica. Infatti gli stati d non essendo completi danno luogo a elevata coesione e quindi a temperatura di fusione e proprietà meccaniche elevate; inoltre elettroni d danno luogo, nel Fe, Co e Ni, a ferromagnetismo.
All'occupazione degli stati 4f corrisponde la serie dei lantanidi. Questi elementi hanno spiccate proprietà metalliche e si ossidano facilmente. Gli elettroni 4f sono responsabili delle proprietà ferromagnetiche e antiferromagnetiche.
Analogamente l'orbitale 5f dà luogo alla serie dei metalli attinidi, importantissimi per l'industria nucleare.
Legame metallico
La struttura cristallina compatta e in generale le proprietà fisiche tipiche dei solidi metallici (elevata conducibilità elettrica e termica, elevata lucentezza, buona malleabilità, elevata duttilità, ecc.) risultano interpretabili in base al tipo di legame chimico che li caratterizza noto come legame metallico.
Schematicamente un cristallo metallico può essere assimilato a un reticolo di ioni positivi costituiti essenzialmente dal nucleo atomico e dagli elettroni negli orbitali atomici più interni; gli elettroni più esterni, cioè gli elettroni di valenza, non appartengono più al singolo atomo ma permeano il reticolo e partecipano alla coesione.
Possiamo quindi pensare un cristallo metallico come costituito da un reticolo di ioni positivi immersi in un mare di elettroni (gli elettroni di valenza) che non solo partecipano alla coesione ma ne costituiscono l'elemento legante.
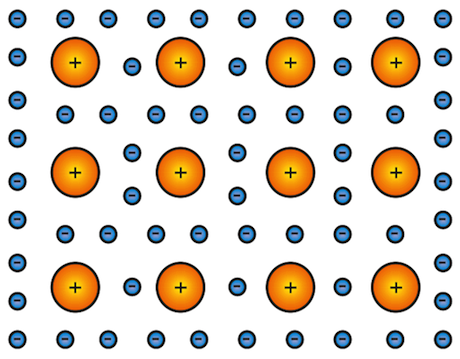
Rappresentazione del legame metallico.
La coesione dei solidi è quindi dovuta all'interazione attrattiva elettrostatica fra le cariche negative degli elettroni e quelle positive dei nuclei atomici; queste forze attrattive sono equilibrate - nel reticolo - da quelle repulsive dovute principalmente alla repulsione tra gli elettroni interni e tra i nuclei atomici carichi positivamente di ioni adiacenti.
Struttura cristallina dei metalli
I metalli presentano strutture molto compatte, e principalmente:
- cubica a corpo centrato (c.c.c.);
- cubica a facce centrate (c.f.c.);
- esagonale compatta (e.c.).
Considerando, ad esempio, i più comuni metalli a temperatura ambiente, il cromo, il ferro, il bario e il tungsteno presentano struttura cubica a corpo centrato; l'alluminio, il rame, l'argento, l'oro e il piombo presentano struttura cubica a facce centrate, mentre hanno struttura esagonale compatta il berillio, il magnesio e il cobalto.
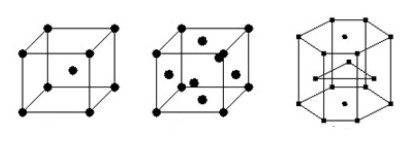
Struttura cristallina dei metalli: a sinistra la cubica a corpo centrato, al centro la cubica a facce centrate e a destra l'esagonale compatta.
La struttura cristallina di un metallo, oltre che dalla natura chimica, dipende dalle variabili fisiche, in particolare la temperatura e la pressione.
A pressione ambiente numerosi metalli, particolarmente nelle serie di transizione e degli attinidi, presentano, al variare della temperatura, più di una struttura cristallina. Esempi significativi sono quelli del plutonio, con sei stati allotropici, del manganese con quattro, dell'uranio con tre e del ferro che presenta struttura cubica a corpo centrato al di sotto di 910 °C, cubica a facce centrate fra questa temperatura e 1390 °C, per divenire poi nuovamente cubica a corpo centrato. Queste transizioni di fase, in particolare quella del ferro, hanno grande importanza tecnologica.
Metalli superconduttori
A temperature molto basse, inferiori a una temperatura critica caratteristica, dell'ordine di alcuni kelvin, numerosi elementi presentano una brusca transizione allo stato superconduttore, caratterizzato da perfetto diamagnetismo e resistività elettrica pressoché nulla.
Il fenomeno (attribuito alla formazione di uno stato ordinato degli elettroni di conduzione) non è specifico dei metalli, ma è stato osservato pure in composti semiconduttori. Tipici metalli superconduttori sono l'alluminio, il titanio, il gallio, il mercurio, il piombo, il tungsteno, e altri.
Fra gli elementi in cui la superconduttività non è stata osservata sono tutti i metalli e le terre alcaline, i metalli nobili e gli elementi magnetici (i cui cristalli possono presentare ferromagnetismo o antiferromagnetismo).
In proposito si noti che un campo magnetico sufficientemente intenso distrugge lo stato superconduttore.
Link correlati:
Qual è il valore della densità dei metalli?
Qual è il peso specifico dei metalli?
Che cosa sono i metalloidi?
Quali sono i metalli detti terre rare?
Esercizi online e gratuiti sulla nomenclatura degli ossidi
Studia con noi