Silicati
Che cosa sono i silicati?
I silicati sono i minerali più abbondanti e diffusi nelle rocce della litosfera. Sono caratterizzati da una struttura che ha per unità fondamentale il gruppo (SiO4)4−, costituito da un tetraedro al centro del quale si trova uno ione silicio e ai vertici i quattro ioni ossigeno.
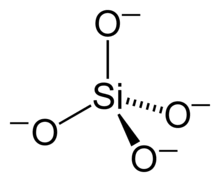
Nella struttura dei silicati i tetraedri SiO4 possono essere isolati, oppure, dal momento che ciascuno dei quattro ioni ossigeno può essere legato a uno o due ioni silicio, possono formare gruppi complessi isolati, o catene estese, o strati, o aggregati tridimensionali. Si conoscono anche composti del silicio con strutture miste in cui possono essere contemporaneamente presenti raggruppamenti diversi di tetraedri.
Classificazione dei silicati
I silicati vengono classificati a seconda del diverso modo di aggregarsi dei tetraedri in cinque principali gruppi indicati di seguito.
Il meccanismo del raggruppamento dà origine a un rapporto caratteristico Si/O per ogni tipo di silicato; tuttavia può accadere che siano presenti nel reticolo anche ioni ossigeno non legati al silicio.
1) Nesosilicati
Natura del raggruppamento: gruppi isolati SiO4
Rapporto Si/O: 1/4
Esempi: olivina, granato
2) Sorosilicati
Natura del raggruppamento: gruppi isolati Si2O7 ; Si6O18 , ecc.
Rapporto Si/O: 2/7 ; 6/18 ; ecc.
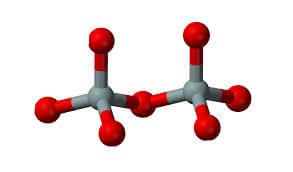
Raggruppamento Si2O7 dei sorosilicati.
Esempi: thortveitite, berillo.
3) Inosilicati
Natura del raggruppamento: catene sviluppate in una sola direzione
Rapporto Si/O: ⅓ ; 4/11
Esempi: anfiboli, pirosseni.
4) Fillosilicati
Natura del raggruppamento: raggruppamenti sviluppati nel piano
Rapporto Si/O: ⅖
Esempi: miche, argille, talco, clorite.
5) Tectosilicati
Natura del raggruppamento: raggruppamenti tridimensionali
Rapporto Si/O: ½
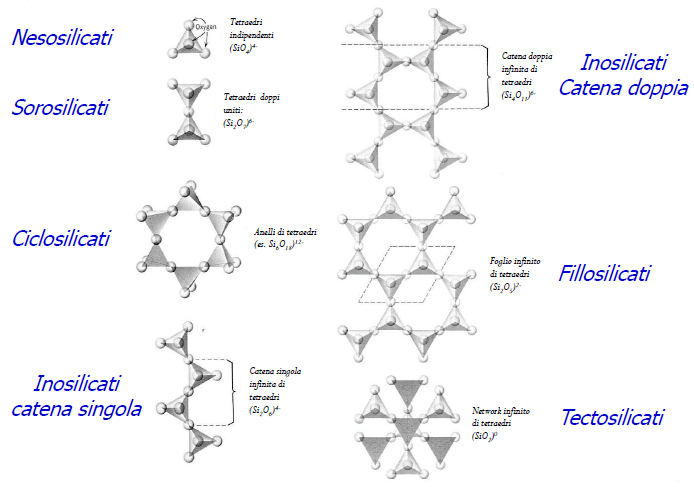
Classificazione dei silicati secondo la struttura chimica.
I silicati vengono generalmente considerati come sali degli acidi del silicio, alcuni dei quali sono puramente ipotetici: sotto questo punto di vista i silicati possono essere classificati in ortosilicati, trisilicati, metasilicati, ecc.; tale classificazione attualmente è da considerare superata.
Struttura dei silicati
Nella cristallochimica dei silicati un elemento importantissimo, che determina in gran parte la complessità chimica di questi composti, è il doppio ruolo esplicato dall'alluminio nella struttura cristallina.
Il rapporto delle dimensioni ioniche di questo ione con quello dell'ossigeno è prossimo al valore critico tra coordinazione 4 e coordinazione 6; l'alluminio può quindi trovarsi nell'una o nell'altra o in ambedue le forme di coordinazione.
Quando nella struttura l'alluminio trivalente è in gruppo di coordinazione 4, esso viene a sostituire lo ione tetravalente del silicio non saturando una valenza dell'ossigeno e richiedendo di conseguenza la sostituzione di un altro catione in qualche altra posizione nella struttura cristallina per saturare detta valenza. Questa situazione generalmente determina la sostituzione di un catione monovalente (ad esempio Na+) con uno bivalente (ad esempio Ca2+); meno frequentemente si ha invece la sostituzione di uno ione bivalente con uno trivalente.
Altri meccanismi meno frequenti comportano eliminazioni o sostituzioni tra i gruppi anionici della struttura.
In alcuni silicati, come quelli con un motivo strutturale silicio-ossigeno basato su forme polimorfe della silice, la sostituzione del silicio da parte dell'alluminio è compensata dall'entrata di un catione, come il sodio, che si dispone in interstizi vuoti della struttura cristallina.
Proprietà e usi dei silicati
Le proprietà cristallografiche e fisiche dei vari silicati sono strettamente connesse con il motivo strutturale del gruppo di silicati a cui appartengono. I fillosilicati hanno abito cristallino appiattito con facile sfaldatura secondo i piani strutturali e sono otticamente negativi con birifrangenza piuttosto elevata.
Gli inosilicati dotati di un motivo strutturale basato su un'associazione di tetraedri SiO4 estesa in una direzione preferenziale (sono cioè più unidimensionali che bidimensionali) generalmente formano cristalli di abito prismatico o aciculare; se presentano sfaldatura, questa è parallela alla direzione di allungamento.
I tectosilicati, invece, generalmente sono ugualmente sviluppati in tutte le direzioni, senza particolare facilità di sfaldatura secondo alcune direzioni e tendono ad avere una birifrangenza relativamente bassa.
Importanza dei silicati
I silicati, come componenti minerali delle rocce, costituiscono la massa principale della parte esterna della superficie terrestre. Molti di essi hanno notevole importanza anche economica, come le argille per i laterizi; i feldspati e l'andalusite per l'industria ceramica; le miche come isolanti elettrici; l'amianto (in passato) e la vermiculite espansa negli isolamenti termici; il granato per gli abrasivi; il talco viene poi usato sia per l'industria cartaria sia per quella dei cosmetici.
Altri silicati naturali sono noti come minerali metalliferi: il berillio è ottenuto dal berillo; zirconio e afnio dallo zircone; il torio dalla torite.
Numerosi altri silicati vengono utilizzati come materiale gemmologico allo scopo di ricavarne pietre preziose e semi-preziose: zircone, tormalina, olivina, topazio, scapolite, nefrite, giadeite, ecc.
Studia con noi