Eteri
Nomenclatura IUPAC, proprietà, reattività e metodi di preparazione degli eteri
Gli eteri sono composti in cui due gruppi alchilici R ed R' (che possono essere diversi ma anche uguali) sono legati allo stesso atomo di ossigeno. La loro formula generale è: R—O—R'.
Nomenclatura IUPAC degli eteri
Per la nomenclatura tradizionale degli eteri i nomi dei due gruppi alchilici o arilici legati all'ossigeno vanno elencati in ordine alfabetico e a questi si fa seguire la parola etere. Pertanto:
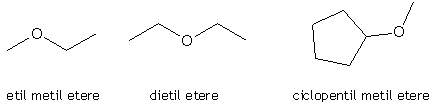
Nella nomenclatura IUPAC gli eteri vengono invece denominati come alcossi-derivati del residuo a catena più lunga:
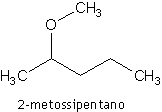
Proprietà
Gli eteri sono composti a molecola polare. Ciò è dovuto alla geometria angolata del legame R—O—R causata dall'ibridazione sp3 dell'atomo di ossigeno:
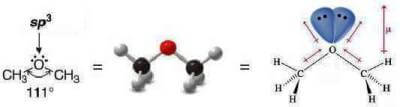
Gli eteri hanno punti di ebollizione piuttosto bassi in quanto non possono associarsi tra di loro mediante legami a idrogeno.
Malgrado questo, la presenza dell'ossigeno permette la formazione di legami a idrogeno con l'acqua:
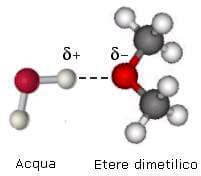
Questo è il motivo per cui gli eteri a bassa peso molecolare (in particolare il dimetiletere) sono solubili in acqua. Per lo stesso motivo gli eteri sono solubili anche negli alcoli.
Metodi di preparazione degli eteri
Gli eteri possono essere preparati in vari modi:
Condensazioni di alcoli
Gli eteri possono essere ottenuti per condensazione di alcoli. Tale reazione si ottiene trattando un alcol con H2SO4. Per favorire la condensazione piuttosto che la disidratazione dell'alcol bisogna operare ad una temperatura più bassa di quella necessaria per disidratare l'alcol stesso ad alchene.
![]()
Per approfondimenti si veda: condensazione di alcoli.
Sintesi di Williamson
Gli eteri possono essere ottenuti per reazione tra uno ione alcossido (RO−) e un alogenuro alchilico (R-X). Tale reazione è nota con il nome di sintesi di Williamson.
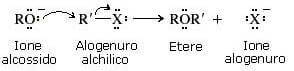
Per approfondimenti si veda: sintesi di Williamson.
Reazione degli alcoli con diazometano
Gli alcoli possono essere metilati per reazione con diazometano in presenza di un acido di Lewis (es. BF3).
![]()
Reazioni degli eteri
Gli eteri sono generalmente composti con una bassa reattività. Per questo motivo e per la loro capacità di sciogliere sostanze apolari, vengono spesso utilizzati come solventi in molti reazioni organiche.
Gli eteri (soprattutto se a basso peso molecolare) sono sostanze estremamente pericolose. Ad esempio, l'etere etilico è estremamente infiammabile ed altamente volatile; per tali motivi può formare con l'aria miscele esplosive.
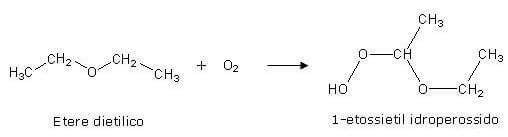
Un'altra proprietà degli eteri è che si ossidano facilmente all'aria per dare idroperossidi altamente esplosivi.
La reazione tipica degli eteri è la scissione acido-catalizzata. Attraverso questa reazione si ha la rottura del legame C-O degli eteri.
Eteri ciclici
Gli eteri ciclici invece sono composti ciclici contenenti un atomo di ossigeno nell'anello.
Epossidi
Gli epossidi (o ossirani) sono i derivati dell'ossido di etilene.
Eteri corona
Gli eteri corona (Crown Ethers) sono polieteri ciclici ad anello grande nella cui struttura si ripete l'unità -CH2-CH2-O-.
Esercizi sugli eteri
Li trovi al seguente link: esercizi sugli eteri.
Studia con noi