Legame a Idrogeno
Generalità e proprietà del legame a idrogeno
Il legame a idrogeno è un particolare tipo di interazione dipolo-dipolo che si viene a formare tra molecole nelle quali un atomo di idrogeno è legato covalentemente con un atomo di piccole dimensioni e fortemente elettronegativo (F, N e O).
Ne sono esempio l'acqua (H2O), l'ammoniaca (NH3) e il fluoruro di idrogeno (HF).
Tale legame viene indicato con una linea tratteggiata che unisce l'idrogeno di una molecola con l'elemento fortemente elettronegativo (F, N, O) dell'altra molecola.
La sua energia di legame (20-50 kJ/mol) è nettamente superiore a quella delle altre forze intermolecolari.
Nella figura seguente è rappresentato il legame a idrogeno tra molecole di acqua e di ammoniaca:
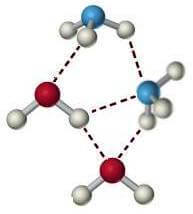
Come si è detto, in questa forza intermolecolare, uno o più atomi di idrogeno sono legati covalentemente ad un elemento più elettronegativo (F, N e O). In queste condizioni si viene a creare un dipolo in cui l'atomo o gli atomi di idrogeno rappresentano la parte positiva.
Se l'elemento a cui è legato l'atomo di H è fortemente elettronegativo (F, N ed O), la positivizzazione (protonazione) dell'atomo di H è tale da consentire ad esso di legare, con legame essenzialmente elettrostatico, un altro atomo elettronegativo.
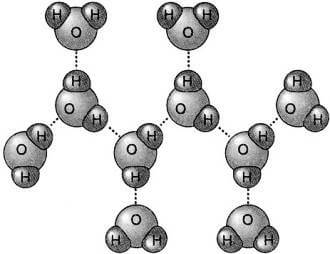
Le piccolissime dimensioni dell'atomo di H, la presenza in esso di un solo elettrone e quindi l'assenza di elettroni di schermo, rendono particolarmente intenso il campo elettrico dell'atomo H protonizzato, e ciò rende possibile la formazione di legami elettrostatici con sensibile energia di legame; questo comportamento è caratteristico del solo atomo H (da qui il nome di legame a idrogeno).
Atomi di dimensioni maggiori, anche se positivizzati con lo stesso meccanismo, non danno luogo a legami di questo tipo a causa delle azioni di schermo degli elettroni sottostanti.
L'atomo H protonizzato di una molecola, può legare con legame elettrostatico soltanto un altro atomo, fortemente elettronegativo e che disponga di una coppia di elettroni di valenza libera (lone pair); legato tale atomo, il piccolissimo atomo H si trova imprigionato fra due atomi di dimensioni assai maggiore delle sue (i due atomi elettronegativi), e non è possibile ad un terzo atomo avvicinarsi tanto all'atomo H da poterne subire attrazione elettrostatica.
Conseguenze del legame a idrogeno
L'esistenza di tale legame si riflette su alcune proprietà fisiche delle sostanze interessate.
Se confrontiamo ad esempio le temperature di ebollizione dei composti HF, HCl, HBr, HI notiamo che tale valore diminuisce costantemente al diminuire della massa molecolare a eccezione del fluoruro di idrogeno HF.
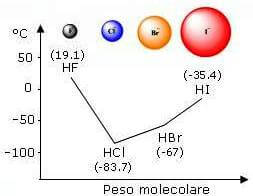
L'alta temperatura di ebollizione del fluoruro di idrogeno HF è dovuta alla presenza del legame a idrogeno: le molecole per poter passare allo stato gassoso devono rompere i forti legami a idrogeno che le tengono unite e questo richiede una temperatura maggiore.
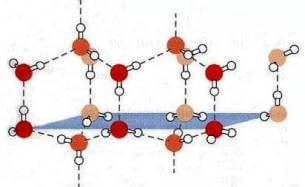
Il legame a idrogeno spiega anche il motivo per cui la densità del ghiaccio è inferiore a quella dell'acqua.
Infatti quando l'acqua congela le molecole sono costrette a distanziarsi per formare la struttura esagonale ordinata tipica del ghiaccio, meno densa della struttura disordinata tipica dell'acqua allo stato liquido:
Il legame a idrogeno spiega anche l'elevata solubilità dello zucchero in acqua.
Link correlati:
Qual è la differenza tra legame covalente e ionico?
Studia con noi