Acido aspartico
Caratteristiche dell'acido aspartico
L'acido aspartico è un amminoacido con catena laterale acida, che prende il nome dall'asparago, il vegetale da cui è stato isolato per la prima volta; esso è presente nelle proteine nella configurazione L.
Il suo nome secondo la nomenclatura IUPAC è acido 2(S)-ammino-1,4-butandioico, ma è conosciuto anche col nome di acido L-α-amminosuccinico, e viene indicato con le sigle Asp e D.
La sua formula di struttura è la seguente:
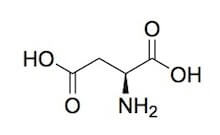
Acido L-aspartico.
Spesso ci si riferisce all'acido aspartico come aspartato, che è la base coniugata dell'acido, ossia la sua forma ionizzata e quella predominante nell'organismo.
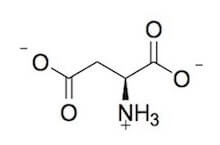
L-aspartato.
La sua catena laterale contiene un gruppo carbossilico, che gli conferisce una pkR (la costante di dissociazione acida del gruppo R) di 3,9, mentre la pk1 (la costante di dissociazione acida del gruppo carbossilico) e la pk2 (la costante di dissociazione acida del gruppo amminico) sono rispettivamente pari a 1,99 e 9,9.
La cisteina ha un pI (punto isoelettrico) di 2,85.
La sua formula bruta è C4H7NO4 e quindi esso ha una massa molare di 133,1 g/mol.
Esso si presenta come un solido cristallino bianco e ha una solubilità in acqua pari a 4 g/L a 20°C.
Infine, la sua temperatura di fusione è 270 °C.
Proprietà dell'acido aspartico
L'acido aspartico è contenuto prevalentemente nei seguenti alimenti: soia, uovo, merluzzo, alghe, lievito di birra, lupini, carne, arachidi, pesci (storione, tonno, salmone).
Esso si trova anche nel dolcificante aspartame, che è un dipeptide ottenuto sinteticamente dalla reazione tra l'acido aspartico e l'estere metilico di un altro amminoacido, la fenilalanina.
Questa molecola ha le stesse calorie del saccarosio, ma ha un potere dolcificante superiore di circa 200 volte, quindi per avere lo stesso sapore è necessaria una dosa di aspartame molto inferiore rispetto a quella di zucchero.
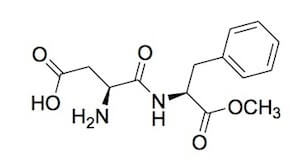
Aspartame.
L'aspartato esercita un effetto stimolante la secrezione, da parte della ghiandola pituitaria (o ipofisi), degli ormoni prolattina (che stimola la produzione di latte della ghiandola mammaria), ormone luteinizzante (che negli uomini aumenta la sintesi di testosterone, mentre nelle donne regola l'ovulazione) e ormone della crescita.
È stato dimostrato che anche il D-aspartato aumenta la produzione di testosterone.
Un'altra interessante proprietà dell'amminoacido è l'effetto immunostimolante che esso esercita sul timo, la ghiandola che ha la funzione di far maturare i linfociti T, importanti costituenti del sistema immunitario.
L'aspartato ha anche la funzione di neurotrasmettitore, fungendo da agonista parziale dei recettori glutammatergici NMDA, legati anche dal derivato metilato dell'aspartato, l'N-metil-D-aspartato, da cui essi prendono il nome.
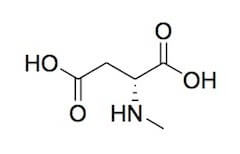
N-metil-D-aspartato (NMDA).
Un apporto fortemente eccessivo di aspartato determina un'aumento della concentrazione del glutammato.
Ciò può portare a un'eccessiva stimolazione dei recettori glutammatergici, portando ad eventi cerebrovascolari o fenomeni convulsivi.
Inoltre, si è visto che in alcuni casi i pazienti epilettici o che hanno subito un ictus, presentano elevate quantità di aspartato, che è, invece, spesso presente in quantità ridotte in pazienti affetti da depressione o atrofia cerebrale.
Magnesio e zinco contrastano in parte le azioni sul sistema nervoso svolte dall'aspartato.
L'aspartato è impiegato per contrastare la fatica cronica.
Inoltre, esso riduce i livelli di ammonio.
Una sua carenza può determinare incapacità di sintetizzare ed espellere l'urea, il maggior prodotto di scarto dell'organismo, in particolare in presenza di una dieta iperproteica.
Ciò può determinare la sintesi di metaboliti tossici contenenti azoto che possono condurre a fatica, confusione, mal di testa, irritabilità, depressione e psicosi.
In genere, comunque, l'acido aspartico è una molecola relativamente sicura.
Biochimica dell'acido aspartico
L'acido aspartico è un amminoacido non essenziale nei mammiferi, perché viene sintetizzato nell'organismo a partire da ossalacetato e glutammato, coinvolti nella reazione di transamminazione ad opera dell'enzima aspartato amminotransferasi (o aspartato transaminasi o transaminasi glutammico-ossalacetica), un enzima presente in due isoforme: la prima (GOT1 o cAST) si trova nel citoplasma delle cellule cardiache e dei globuli rossi, mentre la seconda (GOT2 o mAST), si trova prevalentemente nei mitocondri del fegato.
Questo enzima utilizza la vitamina B6 come cofattore e catalizza la reazione reversibile di formazione dell'aspartato e dell'α-chetoglutarato a partire da ossalacetato e glutammato.
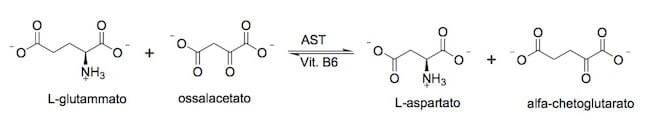
Reazione di transamminazione.
Essendo tale reazione reversibile, l'aspartato diventa così un importante fonte di ossalacetato, che è una molecola fondamentale per il metabolismo, poiché entra nel ciclo di Krebs (o ciclo dell'acido citrico), il processo cellulare che è una tappa necessaria per ottenere energia dall'ossidazione delle molecole organiche.
L'aspartato entra nel ciclo dell'urea, donando uno dei due atomi di azoto dell'urea.
Questo processo serve per eliminare l'azoto in eccesso nell'organismo, che altrimenti sarebbe presente in concentrazioni tali da divenire tossico, in particolare per il sistema nervoso.
L'aspartato prodotto dall'amminotransferasi mitocondriale viene trasportato nel citoplasma, dove l'enzima argininosuccinato sintetasi catalizza la reazione dell'amminoacido con l'intermedio del ciclo citrullil-AMP per formare argininosuccinato, il metabolita che fornisce l'arginina, che verrà successivamente idrolizzata a urea.
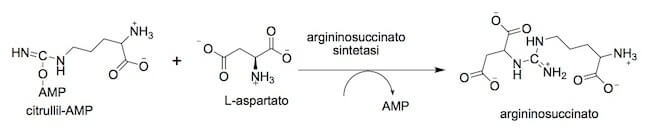
Sintesi dell'argininosuccinato.
L'acido aspartico è il precursore di altri amminoacidi: asparagina (reazione di transammidazione), arginina (ciclo dell'urea), metionina (mediante un lungo processo in più tappe); l'acido aspartico funge da precursore per lisina, treonina e isoleucina solamente nelle piante e nei microrganismi, ma non negli animali e nell'uomo.
Esso è anche uno dei substrati per la biosintesi degli acidi nucleici: le pirimidine (UTP e CTP) in un processo che coinvolge diversi enzimi e le purine, per le quali l'aspartato funge da donatore di azoto.
Durante il processo di traduzione o sintesi proteica, l'amminoacido acido aspartico è codificato dalle triplette di nucleotidi GAU e GAC.
Link correlati:
Che cosa sono gli enzimi transferasi?
Studia con noi