Gruppo carbonilico
Generalità e proprietà del gruppo carbonilico
Il gruppo carbonilico >C=O è il gruppo caratteristico di molti composti tra cui aldeidi, chetoni, acidi carbossilici, etc.
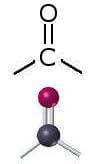
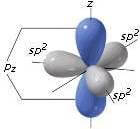
L'atomo di carbonio è ibridato sp2 e i tre orbitali si trovano su un unico piano diposti a 120° l'uno dall'altro. Il restante orbitale p del carbonio è perpendicolare a questo piano.
Il doppio legame del gruppo carbonilico è costituito da un legame di tipo σ (sigma) e da un legame di tipo π (pigreco).
Il legame di tipo σ ha origine dalla sovrapposizione di un orbitale ibrido sp2 del carbonio e un orbitale p dell'ossigeno.
Il legame π invece ha origine dalla sovrapposizione del rimanente orbitale p del carbonio (quello perpendicolare al piano costituito dai tre orbitali ibridi sp2) e un orbitale p dell'ossigeno.
Sull'atomo di ossigeno, infine, sono presenti due doppietti elettronici liberi.
L'atomo di ossigeno del gruppo carbonilico ha una elettronegatività molto più elevata dell'atomo di carbonio. Di conseguenza l'ossigeno attrae a sé gli elettroni del doppio legame C=O con una forza maggiore e il legame risulta fortemente polarizzato.
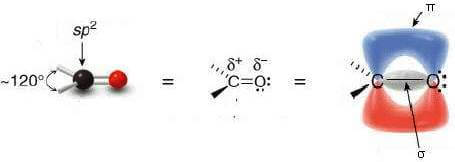
In termini di risonanza, il gruppo carbonilico può essere rappresentato tramite due forme limite, di cui la prima (A) è più stabile della seconda (B):
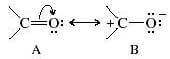
Addizione nucleofila al gruppo carbonilico
La conseguenza alle considerazioni appena fatte è che il gruppo carbonilico può dare facilmente reazioni di addizione nucleofila.
In generale, i chetoni sono meno reattivi delle aldeidi per due ragioni. La prima è per ragioni steriche: l'atomo di carbonio carbonilico è più ingombrato nei chetoni che nelle aldeidi.
Il secondo è dovuto ai gruppi alchilici che tendono a diminuire, per effetto elettron-donatore, la carica positiva del carbonio carbonilico.
La formaldeide, completamente priva di gruppi alchilici, è l'aldeide più reattiva.
L'addizione nucleofila può essere rappresentata come segue:
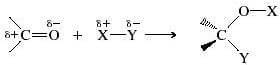
In generale, indicando con Nu: un generico nucleofilo, potremmo scrivere:
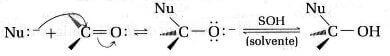
È l'attacco nucleofilo al carbonio carbonilico a indurre la rottura del legame π.
A causa dei doppietti elettronici presenti sull'ossigeno del gruppo carbonilico, la reazione di addizione nucleofila può essere iniziata anche da un attacco elettrofilo sull'atomo di ossigeno del gruppo carbonilico. Gli acidi catalizzano così l'addizione nucleofila al carbonio carbonilico per protonazione dell'atomo di ossigeno:
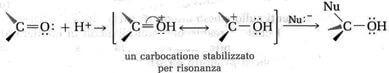
In questo modo il carbonio assume una carica positiva maggiore e l'attacco nucleofilo è reso più semplice.
Link correlati:
Qual è il gruppo arilico?
Studia con noi