Prolina
Proprietà e caratteristiche della prolina
La prolina è un amminoacido con catena laterale apolare, essa è presente nelle proteine nella configurazione L.
Il suo nome IUPAC è acido 2(S)-pirrolidincarbossilico e viene indicata con le sigle Pro e P.
Il suo gruppo laterale è una catena a cinque termini contenente il gruppo amminico e l'atomo di carbonio α; la sua pk1 (la costante di dissociazione acida del gruppo carbossilico) e la sua pk2 (la costante di dissociazione acida del gruppo amminico) sono rispettivamente 1,95 e 10,64. La prolina ha un pI (punto isoelettrico) di 6,3.
L sua formula bruta è C5H9NO2, pertanto essa ha una massa molare di 115,13 g/mol.
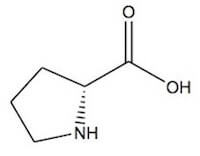
L-prolina.
La prolina si presenta come un solido cristallino bianco, ha una solubilità in acqua pari a 1500 g/L a 20 °C e la sua temperatura di fusione è 220 °C.
Proprietà della prolina
La prolina è un amminoacido non essenziale, in quanto essa può essere prodotta dall'organismo.
Comunque, le principali fonti alimentari di questo amminoacido sono: latticini (grana, gruviera, caprino, pecorino, emmenthal, latte, fontina, edam, tilsit, port salut, cheddar, provolone, monterey, ecc.), semi di senape e di papavero, basilico, spirulina (alga) e soia.
L'assorbimento della prolina nel tratto gastrointestinale dipende dal sodio e l'efficienza del sistema di trasporto è significativamente ridotta quando la sintesi proteica o il metabolismo cellulare sono inibiti, come in caso di terapia antibiotica e di utilizzo cronico di alcol.
La prolina svolge numerose funzioni all'interno dell'organismo. Viene metabolizzata a idrossiprolina, che è uno dei maggiori componenti del collagene, presente in circa il 90% del tessuto connettivo del corpo.
Dato che il collagene è importante per la salute del sistema cardiovascolare, la prolina è importante nel ridurre il rischio di malattie cardiovascolari: essa migliora il metabolismo del colesterolo riducendo la quantità di lipoproteine A, che costituiscono un noto fattore di rischio per l'aterosclerosi.
La carenza di vitamina C, cofattore necessario per la formazione dell'idrossiprolina, può portare allo scorbuto, caratterizzato da una ridotta conversione della prolina in idrossiprolina.
Tra le funzioni della prolina, come già detto, ricordiamo l'aiuto che fornisce alla produzione di collagene, importante per la struttura della pelle e il tono vascolare. Inoltre, è importante per le articolazioni e il tessuto connettivo e promuove la guarigione e il riparo tissutale.
Essa viene sfruttata per la sua funzione di riparo muscolare durante l'esercizio fisico pesante o prolungato.
La prolina ha diverse applicazioni cliniche, in primo luogo viene utilizzata per migliorare la salute cardiovascolare.
È noto che la prolina abbia la capacità di dissociare le lipoproteine A dalle altre lipoproteine contenenti le apoproteine B.
Il legame di apoA con prolina e idrossiprolina potrebbe essere responsabile del legame di apoA alla matrice extracellulare subendoteliale, risultante nella formazione di placche aterosclerotiche, poiché il collagene è un componente essenziale della placca che si può formare a livello delle arterie, in particolare delle arterie coronarie.
L'enzima prolidasi ha un ruolo fondamentale nel riciclo della prolina per la nuova sintesi di collagene e di altre proteine contenenti prolina.
Elevati livelli dell'enzima prolidasi possono portare a un eccesso di prolina che può quindi interagire con molecole di glucosio per formare i cosiddetti AGE (prodotti finali della glicosilazione) che, nel tempo, si depositano nel tessuto endoteliale e vascolare.
Gli AGE possono formare legami crociati col collagene, determinando la formazione di placche aterosclerotiche e aumentando, quindi, l'incidenza di problemi cardiovascolari come, appunto, l'aterosclerosi.
Il collagene è responsabile della stabilità e della resistenza delle placche aterosclerotiche.
La prolina è fondamentale per la formazione di collagene (i residui di prolina e idrossiprolina costituiscono almeno un terzo degli amminoacidi presenti nel collagene), la proteina più abbondante nel corpo umano.
Tutti i tessuti connettivi umani, come pelle, tendini legamenti, cartilagini, articolazioni, ossa, ma anche vasi sanguigni, arterie, vene e vasi linfatici sono formati dal collagene.
Da alcuni studi è emerso che il livello ematico di idrossiprolina aumenti molto in seguito a esercizio fisico.
Questo significa che il metabolismo del collagene possa essere accelerato in questa situazione.
Infatti, i livelli di prolina sono ridotti negli atleti che corrono lunghe distanze, che quindi praticano un'attività per la quale è necessaria molta resistenza, suggerendo che un supplemento dell'amminoacido porterebbe benefici in questi individui e in altri atleti che si allenano in condizioni estreme.
La deficienza di prolina può verificarsi in soggetti che seguono una dieta vegetariana, ma, essendo un amminoacido non essenziale, una sua carenza non causa particolari problemi.
La prolina è usata anche nell'industria farmaceutica come osmoprotettivo e per la preparazione di infusi in combinazione con polifenoli per conferire viscosità alle formulazioni.
Individui con malattie al fegato o ai reni non dovrebbero utilizzare supplementi di amminoacidi, in particolare di prolina, prima di aver consultato il medico.
Biochimica della prolina
La prolina è un derivato ciclico del glutammato, pertanto il suo precursore è l'α-chetoglutarato, necessario per la sintesi del glutammato.
Il processo di sintesi della prolina avviene in 4 tappe.
Nella prima, il gruppo carbossilico della catena laterale del glutammato reagisce con una molecola di ATP, formando il γ-glutammil fosfato e l'ADP.
Questa reazione è catalizzata dall'enzima glutammato chinasi.
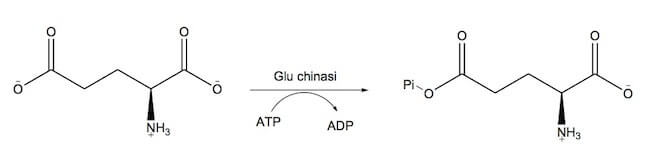
Reazione catalizzata dalla glutammato chinasi.
L'intermedio γ-glutammil fosfato subisce una riduzione a glutammato γ-semialdeide, con perdita del gruppo fosfato.
Questa reazione è catalizzata dall'enzima γ-glutammil fosfato reduttasi, che utilizza il NADP (che si ossida) come cofattore.
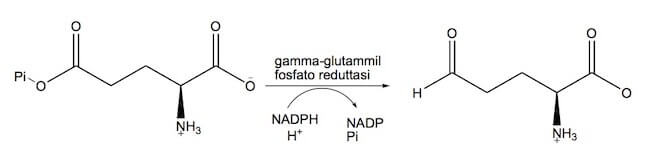
Formazione della glutammato γ-semialdeide.
Il prodotto di questa seconda reazione subisce una rapida e spontanea ciclizzazione non enzimatica.
L'intermedio che si forma è il Δ1-pirrolina-5-carbossilato.
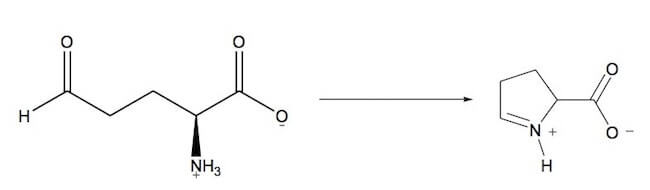
Formazione del Δ1-pirrolina-5-carbossilato.
Infine, questo intermedio viene ridotto a prolina ad opera dell'enzima pirrolina carbossilato reduttasi, che utilizza NADP (anche in questo caso si ossida) in qualità di cofattore.
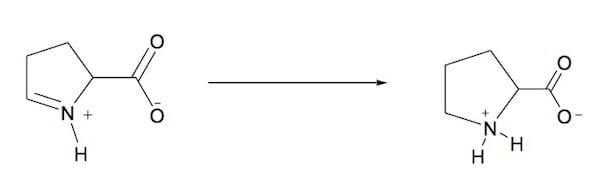
Formazione della prolina.
La prolina può essere sintetizzata anche a partire da un altro amminoacido, l'arginina. Essa, durante il ciclo dell'urea, viene convertita in urea e ornitina.
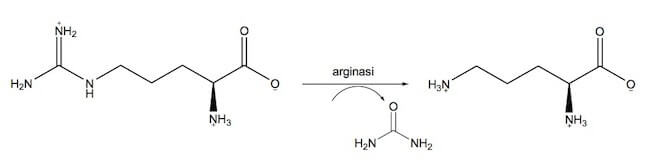
Formazione dell'ornitina.
L'ornitina reagisce quindi con l'α-chetoglutarato (α-KG), per formare, in una reazione reversibile catalizzata dall'enzima ornitina δ-amminotransferasi, glutammato e Δ1-pirrolina-5-carbossilato, che viene in seguito convertito in prolina.
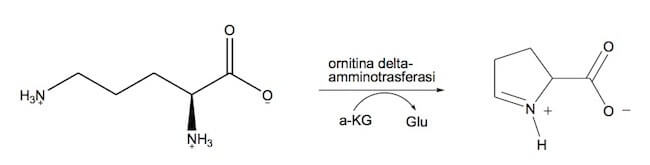
Reazione catalizzata dall'ornitina δ-amminotransferasi.
La prolina, avendo uno scheletro a cinque atomi di carbonio, può subire il processo inverso a quello di sintesi, formando il glutammato, che potrà in seguito essere convertito in α-chetoglutarato, che entra nel ciclo di Krebs, un'importante tappa del metabolismo mitocondriale.
Durante la traduzione o sintesi proteica, l'amminoacido prolina è codificato dalle triplette di nucleotidi CCC, CCA, CCG e CCT.
Link correlati:
Che cosa sono i tropoloni?
Studia con noi