Anodo
Che cos'è l'anodo?
In questa lezione vedremo che cos'è e come è definito l'anodo. L'individuazione dell'anodo è spesso problematica poiché, nei sistemi elettrochimici, come vedremo, talvolta corrisponde al polo positivo (+) e altre volte al polo negativo (-).
Tramite semplici esempi e immagini illustrative cercheremo pertanto di fare chiarezza su un argomento tanto importante della chimica generale e della fisica. Daremo inizialmente una definizione generale di anodo per poi intercalare questa definizione al caso delle pile e al caso delle celle galvaniche.
Definizione di anodo
Nei sistemi elettrochimici l'anodo (dal greco ἄνοδος = "salita"), è l'elettrodo nel quale avviene la semireazione di ossidazione*; di conseguenza il catodo è l'elettrodo nel quale avviene la semireazione di riduzione (piccolo trucchetto per associare i termini: vocale con vocale - anodo, ossidazione - consonante con consonante - catodo, riduzione).
* ricordiamo che una semireazione di ossidazione è una semireazione in cui avviene perdita di elettroni; tali elettroni vengono ceduti a un'altra specie chimica che, acquistando gli elettroni, si riduce. Una ossidazione implica un aumento del numero di ossidazione della specie chimica che reagisce.
L'anodo nelle pile
In particolare, nelle celle galvaniche dette comunemente pile, l'anodo è l'elettrodo sul quale avviene la semireazione di ossidazione e corrisponde al polo negativo (-) della pila.
Prendendo come esempio la pila Daniell, l'anodo è elettrodo nel quale avviene la reazione di ossidazione dello zinco metallico (Zn) a Zn2+ e corrisponde all'elettrodo negativo della pila. In tale elettrodo, lo zinco metallico cede i propri elettroni trasformandosi nello ione Zn2+ secondo la semireazione:
Zn → Zn2 + 2e−
All'anodo c'è quindi produzione di elettroni che, per mezzo del circuito elettrico esterno, giungono sino al catodo nel quale vengono consumati (nel caso della pila Daniell dallo ione Cu2+ che si trova in soluzione e che si riduce a rame metallico secondo la semireazione Cu2+ + 2e− → Cu).
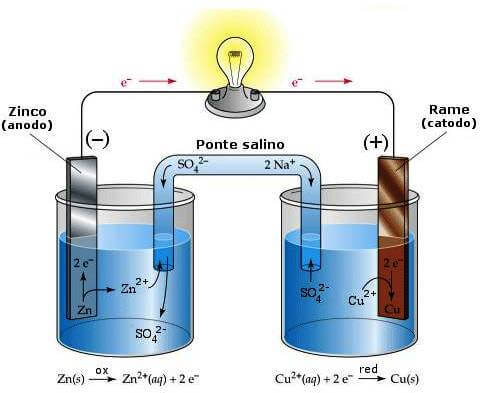
Nella pila Daniell (e nelle pile in generale), l'anodo corrisponde all'elettrodo negativo.
L'anodo nelle celle elettrolitiche
Nelle celle elettrolitiche il discorso è diverso: in esse l'ossidazione viene forzata sottraendo elettroni per mezzo di un generatore di corrente, quindi l'anodo è il polo positivo (+).
All'anodo di una cella elettrolitica avviene sempre la reazione di ossidazione, ma nella cella elettrolitica l'anodo è il polo positivo (+): rispetto ad una pila i segni sono invertiti.
Ad esempio, nell'elettrolisi del cloruro di sodio fuso, all'anodo, caricato positivamente, giungono gli ioni Cl− che danno la seguente semireazione di ossidazione Cl− → ½ Cl2 + e−.
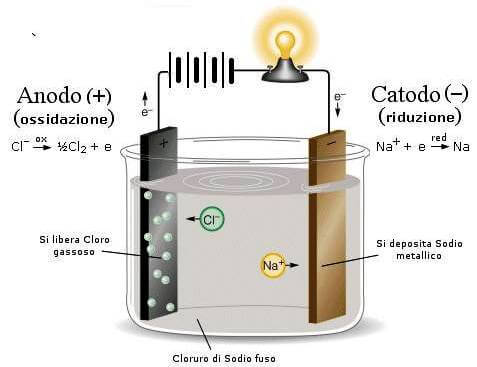
Nel processo di elettrolisi l'anodo corrisponde all'elettrodo positivo.
Riassumendo
1) L'anodo è l'elettrodo nel quale avviene la semireazione di ossidazione.
2) Nelle celle galvaniche (pile), l'anodo corrisponde al polo negativo (-) della pila.
3) Nelle celle elettrolitiche, l'anodo corrisponde al polo positivo (+) della cella.
Link correlati:
Qual è la differenza tra anodo e catodo?
Che cos'è l'anodizzazione?
Studia con noi