Cisteina
Proprietà e caratteristiche della cisteina
La cisteina è un amminoacido con catena laterale polare.
È presente in natura nella configurazione L.
Il suo nome IUPAC è acido 2(R)-ammino-3-mercaptopropanoico e viene indicata con le sigle Cys o C.
La sua catena laterale è polare e idrofila e contiene un gruppo tiolico, che le conferisce una pkR (la costante di dissociazione acida del gruppo R) di 8,37, mentre la pk1 (la costante di dissociazione acida del gruppo carbossilico) e la pk2 (la costante di dissociazione acida del gruppo amminico) sono rispettivamente pari a 1,92 e 10,7.
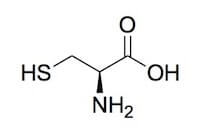
Struttura della cisteina.
La cisteina ha un pI (punto isoelettrico) di 5,05.
La formula bruta è C3H7NO2S e quindi ha una massa molare di 121,16 g/mol.
Essa si presenta come un solido cristallino incolore ed è completamente solubile in acqua.
La sua temperatura di fusione è pari a 224 °C.
Importanza della cisteina e sintomi da carenza
La cisteina, essendo un amminoacido si trova nelle proteine animali e vegetali, quindi le principali fonti alimentari di questo composto sono l'uovo, la soia, la carne (pollame, coniglio, maiale, manzo), il pesce (merluzzo) e i cereali (grano, avena, farro).
La carenza di cisteina porta alla comparsa di sintomi correlati alle funzioni biologiche dell'amminoacido.
I più frequenti sono: debolezza, fatica e riduzione della massa muscolare (la cisteina, come tutti gli amminoacidi, è fondamentale per la sintesi delle proteine che costituiscono i muscoli) e fragilità dei capelli (la cisteina, sotto forma di cistina, costituisce la cheratina dei capelli).
Altri problemi dovuti al ridotto apporto di cisteina includono danni epatici, lesioni cutanee e ipoproteinemia.
L'eccesso dell'amminoacido, invece, è indice di iperomocisteinemia, ossia un aumento della concentrazione ematica di omocisteina, correlato al rischio cardio- e cerebrovascolare.
Biochimica della cisteina
La cisteina è un amminoacido non essenziale, perché viene sintetizzato nell'organismo a partire dalla L-metionina, la quale subisce reazione di transmetilazione ad opera dell'enzima metionina adenosil transferasi, che utilizza una molecola di ATP e porta alla formazione della L-omocisteina e dei sottoprodotti, 3 ioni fosfato (Pi) e S-adenosilmetionina (SAM).
La successiva, che è una reazione reversibile, la transolforazione, è catalizzata dall'enzima cistationina beta sintasi: l'omocisteina reagisce con la L-serina per formare la L-cistationina e una molecola d'acqua.
Reazioni di transmetiliazione e transmetilazione della metionina a formare la cistationina.
Infine, la cistationina entra nella reazione catalizzata dalla cistationina gamma-liasi, che porta alla formazione della cisteina e dell'acido alfa-chetobutirrico.
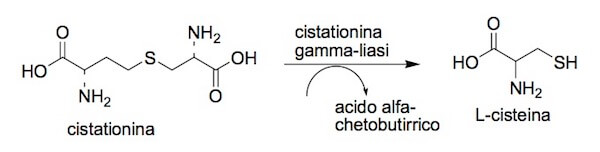
Reazione della cistationina gamma-liasi.
La cisteina è uno dei costituenti (insieme ad acido glutammico e glicina) del tripeptide glutatione, che è un antiossidante fondamentale per le reazioni di detossificazione dell'organismo contro i radicali liberi e altre sostanze nocive, come l'N-acetil-p-benzochinonimmina, il metabolita responsabile dell'effetto epatotossico del paracetamolo.
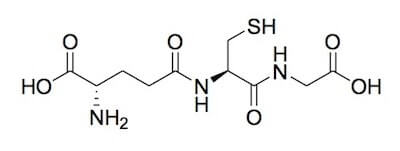
Glutatione.
La cisteina entra anche nella formazione della cistina, che si ottiene per ossidazione di due molecole di cisteina, che determina la formazione del ponte disolfuro (-S-S-).
Questo composto è presente in quantità importanti nella cheratina del tessuto connettivo, che si trova in particolare nei peli, nei capelli e nelle unghie, oltre che nelle corna degli animali.
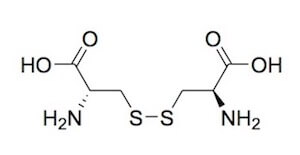
Cistina.
La cisteina è un precursore della taurina, un amminoacido con un gruppo solfonico, che, per coniugazione con gli acidi biliari acido chenodesossicolico e acido colico forma i rispettivi sali taurochenodesossicolato di sodio e taurocolato di sodio.
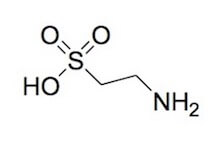
Taurina.
Il derivato acetilato della cisteina, l'N-acetilcisteina, è un noto mucolitico, in grado di scindere i ponti disolfuro delle glicoproteine che costituiscono il muco.
Inoltre, esso è usato come antidoto in caso di avvelenamento da paracetamolo.
Infatti, quando il metabolita tossico del paracetamolo, la già citata N-acetil-p-benzochinonimmina, si trova nell'organismo in grandi quantità, consuma le riserve di glutatione dell'organismo, che possono essere ripristinate in seguito alla somministrazione di N-acetilcisteina.
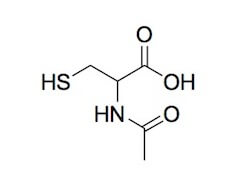
N-acetilcisteina.
La cisteina, essendo un amminoacido costituito da tre atomi di carbonio, può essere convertita in piruvato in un processo che prevede due tappe, la rimozione dello zolfo e la transamminazione.
Il piruvato ottenuto potrà, quindi, essere utilizzato per sintetizzare l'acetil-coenzima A, precursore dei corpi chetonici, o per la gluconeogenesi.
Durante il processo di traduzione o sintesi proteica, l'amminoacido cisteina è codificato dalle triplette di nucleotidi TGT e TGC.
Link correlati:
Che cosa è la creatina?
Che cos'è l'ergosterolo?
Che cosa sono le liasi?
Studia con noi