Quantizzazione dell'energia
Che cosa si intende per energia quantizzata?
Uno dei problemi più insidiosi che i fisici dell'inizio del Novecento si trovarono a risolvere era la spiegazione dell'emissione di radiazione del corpo nero i cui risultati sperimentali portavano a un grafico a forma di campana.
Secondo la teoria classica un corpo nero che riceveva una certa quantità di energia dalla radiazione elettromagnetica avrebbe dovuto a sua volta riemetterla su tutte le lunghezze d'onda comprese quelle dei raggi X e raggi gamma portando ad un risultato non fisicamente plausibile: cioè una quantità di energia emessa infinita (Area sottesa dalla curva).
Questa assurdità fu definita dai fisici dell'epoca catastrofe dell'ultravioletto proprio perché l'andamento tipicamente a campana dello spettro di emissione del corpo nero ottenuto sperimentalmente si discostava notevolmente dalla previsione classica (legge di Rayleigh Jeans) a partire proprio dalle lunghezze d'onda appartenenti all'ultravioletto:
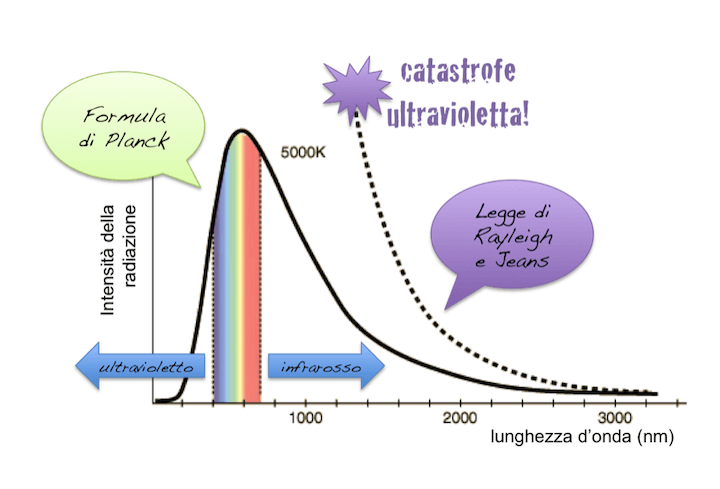
Fu Planck a risolvere il problema introducendo un'ipotesi del tutto nuova nel 1900. Mentre nei calcoli precedenti a quelli di Planck si era assunto che lo scambio di energia tra corpo nero e radiazioni avvenisse in modo continuo, egli introdusse un'ipotesi nuova, secondo cui invece tale scambio avviene attraverso lo scambio di pacchetti di energia chiamati quanti.
Planck ipotizzò che l'energia emessa fosse direttamente proporzionale alla frequenza f dell'onda mediante la relazione:
E = n∙h∙f
in cui h è la costante di Planck che assume valore pari a 6,626∙10-34 J∙s ed n è un numero intero positivo.
Per cui l'energia che un corpo nero assorbe da un'onda elettromagnetica è quantizzata cioè può assumere solo valori multipli di una quantità base cioè il prodotto di h∙f. Ogni pacchetto di energia o quanto ha energia pari a h∙f.
In tal modo si spiegava molto bene perché il picco di emissione del corpo nero era sempre compreso tra infrarosso e visibile: proprio perché sono gli stati più probabili che i quanti di energia possono occupare. Il corpo nero emetterà una quantità bassa di onde radio / microonde perché i loro stati richiedono poca energia.
Così come le emissioni di raggi X e gamma sono ridotte o nulle in quanto ci vorrebbe troppa energia per emettere radiazione.
Effetto fotoelettrico ed energia quantizzata
Nel 1905 Einstein riprese l'ipotesi di Planck sulla quantizzazione dell'energia scambiata tra radiazione e materia per spiegare l'effetto fotoelettrico.
L'effetto fotoelettrico è un fenomeno inspiegabile con le sole teorie fornite dalla fisica classica. Consiste nel far incidere radiazione elettromagnetica su una lastra metallica, solitamente ultravioletta, con conseguente emissione di elettroni dalla lastra.
Era però inspiegabile il fatto che sotto una certa ben precisa frequenza non venisse emesso nessun elettrone anche intensificando notevolmente la potenza della radiazione incidente. Oltrepassando però la frequenza soglia anche con un fascio di bassissima intensità si riusciva a provocare la fotoemissione elettrica.
Einstein quindi comprese che anche la radiazione elettromagnetica cioè la luce nel suo spettro completo era formata da quanti che chiamò fotoni. Ogni fotone porta con sé una ben precisa energia data proprio dalla stessa relazione che Planck utilizzò per la spiegazione della curva di emissione del corpo nero. Ogni fotone ha un'energia pari a:
E = h∙f
in cui h è la costante di Planck che assume valore pari a 6,626∙10-34 J∙s ed f è la frequenza del fotone.
L'energia anche in questo caso risulta quantizzata cioè si presenta come multiplo intero di h∙f.
Quindi utilizzando un fascio di luce con frequenza inferiore a quella di soglia, inviando anche una quantità notevole di fotoni cioè intensificando l'intensità del fascio si utilizzano fotoni ognuno con un'energia inferiore a quella che serve per strappare un elettrone dalla lastra.
È sufficiente anche un solo fotone con energia pari al lavoro di estrazione dell'elettrone dal metallo per poter assistere al fenomeno della fotoemissione.
Energia dei livelli orbitali atomici
Il modello che Rutherford fornì dell'atomo (atomo di Rutherford) come un sistema composto da un nucleo massiccio positivo in cui sono presenti i protoni e i neutroni ed elettroni che gli orbitano intorno essendo carica negativa spiegava molti fenomeni e chiariva il funzionamento degli atomi e dei processi chimici.
Ma questo modello aveva un grande limite che la fisica classica non riusciva a spiegare. Secondo le leggi dell'elettromagnetismo classico infatti l'elettrone che ruota intorno al nucleo atomico dovrebbe perdere parte della propria energia emettendo radiazione e prima o poi cadere nel nucleo. Invece sappiamo bene che la materia è stabile e ciò non avviene.
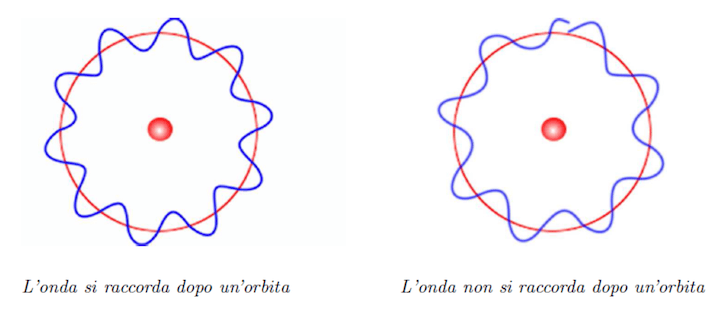
Il cambio radicale di prospettiva si ha se si considera l'elettrone come un'onda dotata di una lunghezza d'onda λ. L'elettrone si trova ad una certa distanza dal nucleo ovvero il raggio R dell'orbita che ne determina l'energia.
Se vogliamo che l'onda si raccordi lungo l'orbita dovremo imporre che la lunghezza dell'orbita deve essere un numero intero di lunghezze d'onda cioè:
2 · π · r = n · λ
Ora imponendo uguaglianza tra forza centripeta e forza elettrica e facendo alcune considerazioni su energia cinetica ed energia potenziale si ottiene che il raggio dell'orbita elettronica è pari a:
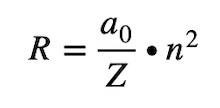
In cui:
- a0 è detto raggio di Bohr (la dimensione tipica di un atomo)
- Z è il numero atomico
- n è un numero naturale 1, 2, 3….
Quindi non tutti i raggi sono ammessi ma solo quelli che rispettano questa condizione. E poiché l'energia totale posseduta dall'atomo dipende dai raggi orbitali avremo che l'energia è data da:
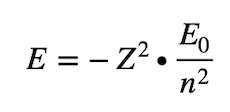
E0 l'energia del livello fondamentale che si dimostra non essere nulla.
Per cui l'energia è quantizzata ovvero risulta essere un multiplo o un sottomultiplo di una quantità ben definita.
Ecco perché l'elettrone non cade nel nucleo perché livelli di energia minori a quello fondamentale non sono ammessi e quindi l'atomo risulta nel suo complesso stabile.
Link correlati:
Che cosa si intende per dualismo onda particella?
Che cosa afferma e su quali postulati si fonda la relatività ristretta?
Cosa rappresenta l'equazione E = m ∙ c2?
Che cos'è la massa relativistica?
Studia con noi