Modello atomico di Thomson e di Rutherford
Modello atomico di Thomson e di Rutherford: spiegazione e definizione dei due modelli atomici
Modello atomico di Thomson
Nel 1904 lo scienziato inglese J.J. Thomson propose il cosiddetto modello a panettone che suscitò numerose curiosità e consensi.
In base ai dati allora disponibili, Thomson immaginò che gli elettroni (negativi) fossero dispersi come gli acini di uvetta in un panettone, in una massa elettricamente positiva, in modo da determinarne l'equilibrio delle cariche.
Modello atomico di Rutherford
Nel 1911 lo scienziato neozelandese E. Rutherford bombardò una sottilissima lamina di oro con raggi alfa.
Le particelle alfa positive passavano nel 99% dei casi attraverso la lamina senza subire deviazioni.
In qualche caso venivano deviate con angoli superiori ai 90°e, in un caso su 8000, venivano respinte indietro.
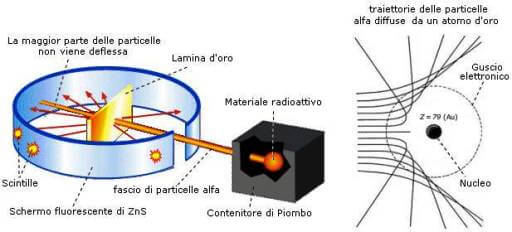
Rappresentazione dell'esperimento di Rutherford.
In base a questi dati Rutherford ipotizzò che:
- Poiché le particelle alfa nella maggior parte dei casi oltrepassavano la lamina d'oro senza subire deviazioni, significava che non incontravano alcun ostacolo sul proprio cammino e che quindi, l'atomo doveva essere formato prevalentemente da spazio vuoto.
- Poiché in qualche caso le particelle alfa venivano deviate e in rarissimi casi venivano riflesse, l'intera carica positiva (protoni) dell'atomo doveva essere concentrata in un "nocciolo" piccolissimo e centrale: il nucleo.
- Gli elettroni negativi dovevano muoversi lungo orbite circolari. Il diametro del nucleo doveva essere centomila volte più piccolo del diametro dell'atomo.
Questo modello atomico è detto modello planetario, poiché ricorda, in miniatura, il Sistema Solare in cui il Sole rappresenta il nucleo dell'atomo e i pianeti gli elettroni, che si muovono lungo le proprie orbite attorno al sole (nucleo dell'atomo).
Anche se geniale il modello atomico di Rutherford non teneva conto di un importantissimo dato sperimentale della fisica: una particella in movimento, elettricamente carica e soggetta ad una accelerazione, perde incessantemente energia.
Poiché ciò deve valere anche per l'elettrone (carico negativamente), esso perdendo progressivamente energia avrebbe finito per muoversi lungo orbite sempre più piccole, fino a cadere, ovvero collassare, sul nucleo atomico (teoria del collasso).
Più in particolare, il moto dell'elettrone attorno al nucleo è il risultato dell'equilibrio tra due forze: quella centrifuga e quella di attrazione elettrostatica verso il nucleo. Gli elettroni pertanto, essendo carichi elettricamente e soggetti ad una accelerazione, avrebbero dovuto emettere onde elettromagnetiche, perdere via via energia e collassare sul nucleo, cosa che nella realtà non si verifica.
Sotto questo punto di vista il modello atomico di Rutherford presentava pertanto importanti contraddizioni rispetto ai principi della fisica classica.
Questo modello atomico, fu successivamente sostituito dal modello atomico di Niels Bohr, che poggiava su presupposti del tutto nuovi.
Link correlati:
Che cosa sono le regole di selezione?
Che cosa afferma il modello atomico di Dalton?
Che cosa afferma il modello atomico a orbitali?
Studia con noi