Acido tiosolforico
Proprietà e caratteristiche dell'acido tiosolforico
L'acido tiosolforico è un acido ternario con formula chimica H2S2O3.
Presenta la seguente struttura:
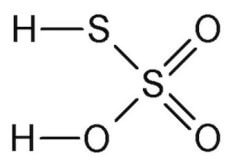
Deriva formalmente dall'acido solforico H2SO4 per sostituzione di un atomo di ossigeno con un atomo di zolfo.
L'acido tiosolforico è assai poco stabile anidro mentre stabili sono i suoi sali (tiosolfati).
Lo ione tiosolforico (tiosolfato) S2O32− è tetraedrico, simile cioè allo ione solforico SO42−, dal quale differisce perché uno degli atomi di ossigeno che sono ai vertici del tetraedro è sostituito da un atomo di zolfo.
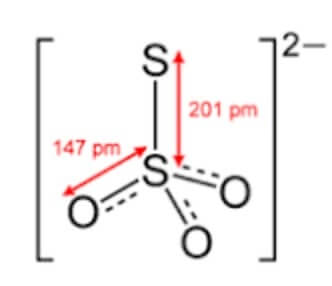
Il numero di ossidazione medio dello zolfo in S2O32− è +2.
Si può preparare tiosolfato di sodio riscaldando all'ebollizione una soluzione di solfito di sodio in presenza di zolfo:
Na2SO3 + S → Na2S2O3
oppure per disproporzione dello zolfo elementare in ambiente alcalino:
4 S + 6 OH− → 2 S2− + S2O32− + 3 H2O
Acidificando una soluzione di tiosolfato di sodio non si ottiene acido tiosolforico (H2S2O3), ma i suoi prodotti di decomposizione:
H2S2O3 → H2O + SO2 + S
La reazione comprende molti stadi intermedi.
Preparazione dell'acido tiosolforico
È possibile preparare direttamente l'acido tiosolforico facendo reagire, a circa -78°C ed in soluzione eterea, triossido di zolfo e solfuro di idrogeno secondo la reazione:
SO3 + H2S → H2S2O3
Reazioni caratteristiche
Lo iodio ossida lo ione tiosolforico a ione tetrationico e questa reazione è usata in chimica analitica per la titolazione dello iodio (si usa come indicatore la salda d'amido):
2 Na2S2O3 + I2 → 2 NaI + Na2S4O6
Il cloro, ossidante più forte dello iodio, ossida i tiosolfati a solfati:
Na2S2O3 + 4 Cl2 + 5 H2O → 8 HCl + 2 NaHSO4
Studia con noi