H2SO4 NaOH
Bilanciamento della reazione tra H2SO4 e NaOH
Nel bilanciamento delle reazioni chimiche è necessario applicare la legge di Lavoisier, sicuramente una delle leggi più importante della chimica. Tale legge afferma che: "nel corso di una reazione chimica la somma delle masse dei reagenti è uguale alla somma delle masse dei prodotti".
In una reazione chimica si ha infatti che i reagenti, ovvero le sostanze di partenza, si trasformano nei prodotti, ovvero le sostanze ottenute nel corso della reazione chimica: in base alla legge di Lavoisier, il numero di atomi di ogni elemento chimico presente nell'equazione deve essere lo stesso sia tra i reagenti che i prodotti.
Fatta questa breve ma necessaria introduzione, vediamo come si bilancia la reazione tra H2SO4 e NaOH.
Bilanciamento della reazione chimica H2SO4 NaOH
Nella reazione chimica citata, H2SO4 (acido solforico) e NaOH (idrossido di sodio) sono i reagenti di una reazione chimica.
Più in particolare, l'acido solforico è un acido mentre l'idrossido di sodio è un idrossido.
In una reazione chimica tra un acido e un idrossido si forma sempre un sale e acqua (H2O). Supponendo che l'acido solforico reagisca completamente il sale che si viene a formare è costituito dagli ioni Na+ derivanti da NaOH e dagli ioni SO42− derivanti da H2SO4.
Applicando la "regola dell'incrocio", il numero di cariche elettriche (che è soltanto una) del sodio diventa l'indice del gruppo SO4 mentre il numero di cariche elettriche dello ione SO42− (che sono 2) diventa l'indice del sodio; pertanto il sale che si viene a formare dalla reazione è il solfato di sodio Na2SO4.
Come detto in precedenza, in una reazione chimica tra un acido e un idrossido si forma anche H2O ottenuta dalla combinazione degli ioni H+ dell'acido e degli ioni OH− dell'idrossido (H+ + OH− → H2O): pertanto i prodotti della reazione sono Na2SO4 e H2O.
In una equazione chimica, che è una rappresentazione in simboli di una reazione chimica, i reagenti e i prodotti sono separati da una freccia orizzontale la cui punta è rivolta verso i prodotti: tale freccia ricorda pertanto che i reagenti si trasformano nei prodotti.
L'equazione chimica non bilanciata della reazione tra H2SO4 e NaOH con formazione di Na2SO4 e H2O è pertanto la seguente:
H2SO4 + NaOH → Na2SO4 + H2O
Vediamo come procedere al bilanciamento di questa equazione chimica: a sinistra, tra i reagenti, abbiamo un solo atomo di Na mentre a destra, tra i prodotti, ne abbiamo due: per bilanciare gli atomi di Na, in modo che siano in ugual numero sia tra i reagenti che tra i prodotti, è quindi necessario anteporre alla formula chimica dell'idrossido di sodio (NaOH) il coefficiente stechiometrico 2: tale coefficiente raddoppia il numero di atomi di sodio (ma anche di O e di H):
H2SO4 + 2 NaOH→ Na2SO4 + H2O
Però, a questo punto, il numero degli atomi di idrogeno tra i reagenti è pari a 4 (due provenienti da H2SO4 e due da 2 NaOH) mentre il numero degli atomi di idrogeno tra i prodotti della reazione è 2.
Ragionando come in precedenza è dunque necessario anteporre alla formula chimica dell'acqua (H2O) il coefficiente stechiometrico 2. Si ha che:
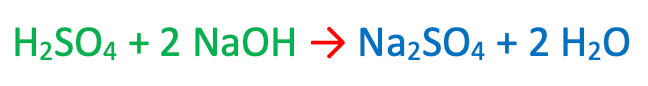
Equazione chimica bilanciata tra H2SO4 e NaOH.
Tale equazione chimica risulta bilanciata, infatti anche gli atomi di ossigeno e di zolfo risultano in uguale numero sia tra i reagenti che tra i prodotti.
Nell'equazione chimica bilanciata si hanno pertanto, sia tra i reagenti (in verde) che tra i prodotti (in blu):
- 4 atomi di H;
- 1 atomo di S;
- 6 atomi di O;
- 2 atomi di Na.
Link correlati:
Esercizi sul bilanciamento delle equazioni chimiche
Bilanciamento della reazione tra Hg e O2 con formazione di HgO
Bilanciamento della reazione tra Mg e HCl
Studia con noi