Etilene
Proprietà e caratteristiche dell'etilene
L'etilene, noto anche come etene, è il primo termine della serie degli alcheni; ha la seguente formula bruta: C2H4.
Ha massa molare di 28,054 g/mol, punto di fusione di -169°C, punto di ebollizione di -103,7°C e in condizioni standard presenta una densità pari a 1,2612 g/L.
Si presenta come un gas incolore, insolubile in acqua e dall'odore gradevole.
La molecola dell'etilene
L'etilene è un composto in cui due atomi di idrogeno sono legati a ciascun atomo di carbonio con legami covalenti semplici, mentre i due atomi di carbonio sono legati tra loro da due legami covalenti (doppio legame).
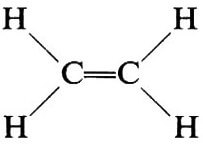
La rappresentazione dell'etilene così descritta è soddisfacente, in quanto rispetta la regola che ciascun atomo di carbonio debba avere attorno a sé , nel guscio più esterno, otto elettroni e ciascun atomo di idrogeno ne debba avere due (regola dell'ottetto).
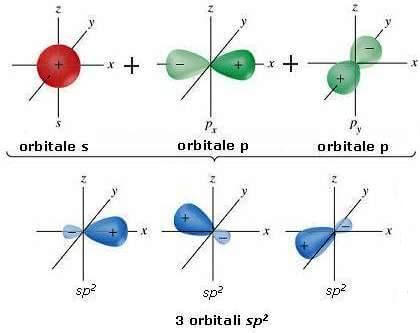
Ciascun atomo di carbonio dell'etilene è ibridato sp2 (si veda: ibridazione orbitalica); tale ibridazione la si ottiene dal mescolamento di un orbitale s con due orbitali di tipo p.
Si ottengono in tal modo 3 orbitali ibridi detti orbitali sp2 che si dispongono su di un piano formando angoli di 120° l'uno dall'altro.
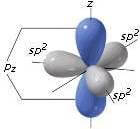
L'orbitale p (di ciascun atomo di carbonio) non coinvolto nell'ibridazione si dispone perpendicolarmente al piano formato dai tre orbitali ibridi sp2
Il doppio legame C=C si realizza in seguito alla sovrapposizione frontale tra due orbitali ibridi sp2 e alla sovrapposizione laterale tra i 2 orbitali p non coinvolti nell'ibridazione.
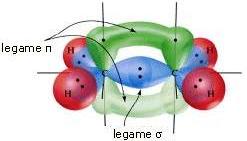
Ciascun legame C-H lo si ottiene in seguito alla sovrapposizione di un orbitale sp2 del carbonio e l'orbitale s di ciascun atomo di idrogeno.
Preparazione dell'etilene
L'etilene viene preparato - in fase vapore e generalmente in assenza di catalizzatori - per deidrogenazione o cracking di frazioni leggere di petrolio.
In alternativa l'etene può essere preparato per cracking di frazioni più pesanti (gasolio, nafta), in presenza di vapore surriscaldato.
In entrambi i processi sopra descritti l'etilene è separato per distillazione frazionata dagli altri idrocarburi.
L'etilene può essere infine ottenuto anche per deidrogenazione dell'etano.
Usi dell'etilene
L'etilene rappresenta uno dei composti chimici più importanti ed è prodotto in grandi. La sua produzione si attesta attorno a 100 milioni di tonnellate/anno e impianti di produzione dell'etilene si trovano in quasi tutti i paesi del Mondo industrializzato.
L'etilene viene impiegato per la produzione di numerosissimi prodotti come ad esempio l'ossido di etilene, lo stirene, il cloruro di etile, il dicloroetano, l'acido propionico, l'etanolo e la cloridrina etilenica.
Per la preparazione dell'acido propionico l'etilene viene fatto reagire con monossido di carbonio e acqua (sintesi di Reppe). La reazione è la seguente:
CH2=CH2 + CO + H2O → CH3CH2COOH
L'etanolo viene invece ottenuto per sintesi a partire da etilene ed acqua attraverso la seguente reazione chimica:
H2C=CH2 + H2O → CH3CH2OH.
Per la preparazione della cloridrina etilenica (CH2Cl―CH2OH) si introduce una miscela di etilene e di biossido di carbonio in soluzione di ipoclorito sodico:
NaClO + H2O + CO2 → NaHCO3 + HClO
HClO + H2C=CH2 → CH2Cl―CH2OH
Molto importante da un punto di vista industriale è la polimerizzazione dell'etilene che porta alla formazione del polietilene (si veda: polimeri).
Ruolo biologico dell'etilene
L'etilene ricopre anche un importante ruolo biologico come ormone vegetale; come fitormone è infatti responsabile della maturazione di molti frutti.
Viene biosintetizzato a partire da un alfa-amminoacido (acido 1-amminociclopropan-1-carbossilico, amminoacido nel quale l'atomo di carbonio alfa fa parte di un anello ciclopropanico).
Studia con noi