Non metalli
Generalità e proprietà dei non metalli
In questa lezione vedemo che cosa sono i non metalli e quali sono le loro proprietà chimiche e fisiche.
Vedremo quale posizione occupano nella tavola periodica, da quali valori di elettronegatività e di affinità elettronia sono caratterizzati e quale è la loro reattività chimica. Risssumeremo infine, in una tabella, le principali proprietà fisiche dei non metalli.
Che cosa sono i non metalli?
I non metalli sono quegli elementi chimici che presentano un aspetto opaco e sono cattivi conduttori di elettricità e di calore. Sono situati a destra della tavola periodica (tranne l'idrogeno che è in alto a sinistra) e presentano caratteristiche fisiche opposte a quelle dei metalli.
A temperatura e pressione ambiente esistono in tutti gli stati di aggregazione della materia: possono essere allo stato gassoso (come l'ossigeno e l'azoto), allo stato liquido (come il bromo) e allo stato solido (come il carbonio e lo zolfo). Sono fragili e hanno solitamente bassi punti di fusione.
Sono non metalli i seguenti elementi (in ordine di numero atomico crescente): idrogeno (H), carbonio (C), azoto (N), ossigeno (O), fluoro (F), fosforo (P), zolfo (S), cloro (Cl), selenio (Se), bromo (Br), iodio (I).
Tra i non metalli alcuni autori considerano anche l'astato che, in realtà, è un elemento chimico che presenta anche caratteristiche metalliche e pertanto, da altri autori, è considerato un semimetallo (i semimetalli sono gli elementi con proprietà chimiche intermedie tra quelle dei metalli e quelle dei non metalli; nella tavola periodica seguente sono quelli su sfondo verde).
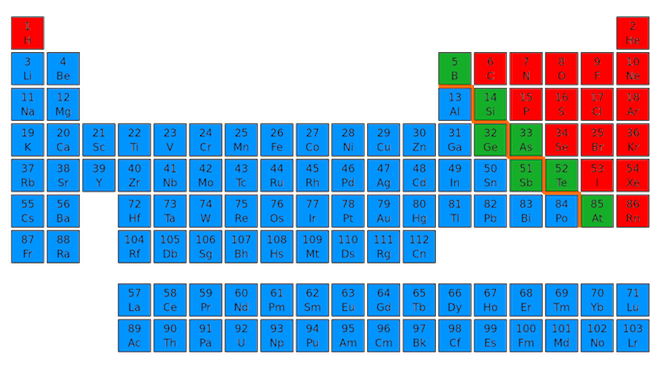
In rosso i non metalli della tavola periodica.
Non metalli possono essere anche considerati i gas nobili, gas che, per la loro particolare struttura elettronica, presentano una bassissima reattività e sono considerati pertanto inerti; essi sono: l'elio (He), il neon (Ne), l'argon (Ar), il kripton (Kr), lo xenon (Xe), il radon (Rn).
Le proprietà fisiche e chimiche dei non metalli a confronto con quelle dei metalli e dei non metalli
Nella seguente tabella mettiamo a confronto le proprietà fisiche e chimiche dei non metalli con quelle dei metalli e dei semimetalli.
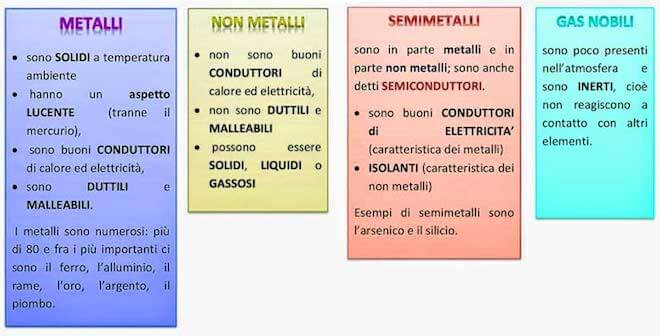
Non metalli e proprietà periodiche
Ga nobili a parte, i non metalli sono caratterizzati da elevata affinità elettronica ed elevata elettronegatività; è per questo motivo che la tendenza generale dei non metalli è quella di acquistare elettroni, cosa che gli permette di raggiungere la configurazione elettronica dei gas nobili che li seguono nel periodo della tavola periodica e quindi di raggiungere la stabilità. Pertanto la loro reattività chimica dipende dalla elevata tendenza che hanno di formare ioni negativi.
Gli elementi non metallici danno luogo alla serie acida dei composti; infatti reagendo con l'ossigeno formano gli ossidi acidi (o anidridi) che, a loro volta reagendo con l'acqua formano gli acidi ternari (o ossoacidi).
Serie acida:
- Non metallo + O2 → Anidride (ossido acido);
- Anidride + H2O → Acido ternario (ossiacido)
Così, ad esempio, lo zolfo reagendo con l'ossigeno forma l'anidride solforica, secondo la reazione:
2 S + 3 O2 → 2 SO3
A sua volta, l'anidride solforica reagisce on l'acqua formano un acido ternario noto come acido solforico:
SO3 + H2O → H2SO4
Principali proprietà dei non metalli
Nella tabella sottostante vengono messi a confronto le proprietà dei non metalli con quelle dei metalli:
Stato fisico
- Metallo: solido (tranne il mercurio che è un liquido)
- Non metallo: solido, liquido, gas
Aspetto
- Metallo: metallico, lucente
- Non metallo: opaco
Flessibilità
- Metallo: malleabile, duttile
- Non metallo: fragile
- Metallo: elevata
- Non metallo: scarsa
Conducibilità elettrica
- Metallo: elevata
- Non metallo: scarsa
Densità
- Metallo: elevata
- Non metallo: bassa
Punto di fusione
- Metallo: elevato
- Non metallo: basso
Reattività chimica
- Metallo: reagisce con i non metalli
- Non metallo: reagisce con i metalli e i non metalli
Studia con noi