Anidride solforosa
Proprietà e caratteristiche dell'anidride solforosa
La anidride solforosa, nota anche come diossido di zolfo è un gas dall'odore empireumatico (tipico di sostanze organiche di origine animale o vegetale carbonizzate per riscaldamento) fortemente irritante per gli occhi e il tratto respiratorio.
All'aria umida dà fumi densi e biancastri.
Si trova libera nelle emanazioni vulcaniche e disciolta in alcune acque naturali che sgorgano nelle vicinanze dei vulcani attivi.
Proprietà chimiche dell'anidride solforosa
L'anidride solforosa allo stato secco non arrossa la cartina al tornasole.
Col riscaldamento è stabile e si decompone solo sopra i 2000°C in S e SO3, SO e O:
SO2 → SO + O
2 SO2 → SO3 + SO
3 SO2 → 2 SO3 + S
oppure:
2 SO2 → S2O2 + O2
Anche fotochimicamente SO2 si decompone in SO, SO3 e O.
L'anidride solforosa dà una reazione esplosiva con il fluoro; con il cloro, in presenza di catalizzatori, dà cloruro di solforile, mentre con il bromo e lo iodio non si combina.
L'ossigeno non reagisce con anidride solforosa in assenza di acqua alla temperatura ordinari; con l'ozono avviene la reazione:
3 SO2 + O3 → 3 SO3
La reazione tra carbonio ed anidride solforosa viene catalizzata da alcuni metalli ed ossidi; tra 950°C e 1100°C avvengono le reazioni:
SO2 + C → CO2 + S
CO2 + C → 2 CO
La formazione dell'ossisolfuro e del solfuro di carbonio è dovuta alle reazioni secondarie:
S + CO → COS
2 S + C → CS2
Coi metalli alcalini, l'anidride solforosa reagisce lentamente a freddo, mente a caldo si ha una reazione vivace con formazione di polisolfuri, tiosolfati e solfati.
Struttura a puntini di Lewis dell'anidride solforosa
La molecola dell'anidride solforosa ha una geometria angolata, con angolo di legame O-S-O di 119°.
La struttura reale del composto è un ibrido delle seguenti strutture risonanti:
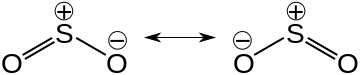
nelle quali l'atomo di zolfo ha numero di ossidazione +4 e una carica formale di +1.
Per approfondimenti si veda: formazione del legame dativo.
Struttura 3D
Anidride solforosa in soluzione acquosa
Lo studio degli spettri infrarossi dimostra che le soluzioni acquose di SO2 non contengono quantità apprezzabili di acido solforoso H2SO3; in queste soluzioni le molecole di SO2 esistono per la maggior parte come tali, in presenza di piccole concentrazioni degli ioni HSO3− e HS2O5− risultanti dagli equilibri:
SO2 + 2 H2O ⇄ HSO3− + H3O+
HSO3− + SO2 ⇄ HS2O5−
Preparazione dell'anidride solforosa
La preparazione dell'anidride solforosa per combustione dello zolfo elementare, e in generale dei composti contenenti zolfo (solfuro di idrogeno, solfuri e solfati inorganici), costituisce la prima fase della produzione dell'acido solforico. La reazione è la seguente:
S + O2 → SO2
Alternativamente SO2 può esssere prodotta per combustione di solfuro di idrogeno in aria:
2 H2S + 3 O2 → 2 SO2 + 2 H2O
Può essere preparata in laboratorio anche per riduzione dell'acido solforico o meglio dell'oleum con 30% di SO3, con lamine o pezzi di rame, argento, carbone o mercurio a caldo
2 H2SO4 + Cu → CuSO4 + 2 H2O + SO2
Il gas che si svolge viene lavato con acqua e seccato con acido solforico concentrato oppure con cloruro di calcio.
I metodi di preparazione in laboratorio non presentano attualmente che un interesse assai limitato, in quanto in commercio si trovano a disposizione bombole d'acciaio di anidride solforica allo stato liquido.
Mancando di una bombola di SO2 liquida, il gas si può preparare facilmente anche per decomposizione a debole calore con acido solforico di una soluzione acquosa concentrata di bisolfito sodico.
Usi dell'anidride solforosa
L'anidride solforosa veniva usata già, dagli Egizi 2000 anni a. C. come sbiancante per biancheria e viene ricordata da Omero come disinfettante.
Anni addietro era largamente usata nell'industria del freddo e per la disinfestazione.
Gli usi attuali dell'anidride solforosa sono:
- 85% per la preparazione dell'acido solforico, dei solfiti, metabisolfiti e idrosolfiti (per sbianca di lana, seta, paglia);
- 10% nelle cartiere come imbiancante della pasta di legno, negli zuccherifici come conservativo, nelle industrie vinicola, della birra, delle carni insaccate e delle conserve di frutta;
- 3% per la raffinazione del petrolio: i composti aromatici non saturi ed i loro composti solforati sono facilmente solubili in anidride solforosa liquida (processo Edeleanu);
- 2% per la deidrociclizzazione delle olefine e paraffine aventi almeno sei atomi di carbonio: usando come catalizzatore una miscela di ossidi di cromo e di alluminio in presenza di anidride solforosa si ottengono idrocarburi aromatici e tiofenici.
Link correlati:
Quali sono i numeri di ossidazione dello zolfo?
Studia con noi