Acido fosforico
Proprietà e caratteristiche dell'acido fosforico
L'acido fosforico noto anche come acido ortofosforico è un acido ternario con formula chimica H3PO4.
Se puro ed anidro si presenta sotto forma di cristalli del sistema monoclino.
Caratteristiche chimiche dell'acido fosforico
L'acido fosforico forma sali neutri, mono- e biacidi; forma esteri.
A temperatura ambiente è abbastanza inattivo.
L'acido fosforico si comporta come un acido triprotico con tre costanti di dissociazione acida corrispondenti ai tre gradi di ionizzazione. Il valore di tali costanti sono rispettivamente: Ka1 = 7,5 · 10-3 ; Ka2 = 6 · 10-8 ; Ka3 = 3 · 10-13, equivalenti ad un acido forte, ad un acido debole e ad un acido molto debole.
H3PO4 + H2O ⇄ H2PO4− + H3O+ (Ka1 = 7,5 · 10-3)
H2PO4− + H2O ⇄ HPO42− + H3O+ (Ka2 = 6 · 10-8)
HPO42− + H2O ⇄ PO43− + H3O+ (Ka3 = 3 · 10-13)
è solubile in etere etilico.
Tramite riscaldamento due molecole di H3PO4 possono condensare eliminando una molecola di H2O. Si ottiene l'acido pirofosforico:
2 H3PO4 → H4P2O7 + H2O
Quando invece dall'acido fosforico H3PO4 viene estratta una molecola di H2O, si ottiene l'acido metafosforico HPO3, un solido di colore bianco:
H3PO4 → HPO3 + H2O
Metodi di preparazione dell'acido fosforico
L'acido fosforico si può ottenere:
1) Dai fosfati di calcio naturali per acidificazione con acidi minerali quale ad esempio l'acido solforico:
Ca3(PO4)2 + 3 H2SO4 → 3 CaSO4 + 2 H3PO4
È il cosiddetto processo ad umido, usato industrialmente.
2) Direttamente dal fosforo bianco per ossidazione e con acido nitrico diluito:
3 P + 5 HNO3 + 2 H2O → 3 H3PO4 + 5 NO
3) Per idratazione dell'anidride fosforica:
P2O5 + 3 H2O → 2 H3PO4
Questo procedimento è usato industrialmente e dà un acido fosforico più puro del processo ad umido.
Procedimenti industriali per ottenere l'acido fosforico
Industrialmente l'acido fosforico può essere ottenuto secondo due vie:
1) Per via umida, partendo direttamente dai fosfati.
Viene realizzata con i metodi seguenti:
a) attacco dei fosfati con acido solforico, successiva separazione del CaSO4 e purificazione e concentrazione dell'acido fosforico ottenuto. Tale processo si basa sulla seguente reazione:
Ca3(PO4)2 + 3 H2SO4 → 3 CaSO4 + 2 H3PO4
b) attacco dei fosfati con acido cloridrico ed estrazione della soluzione cloridrica ottenuta con adatti solventi. Tale processo si basa sulla seguente reazione:
Ca3(PO4)2 + 6 HCl → 3 CaCl2 + 2 H3PO4
c) attacco dei fosfati con acido nitrico e successiva estrazione con solventi adatti. Tale processo si basa sulla seguente reazione:
Ca3(PO4)2 + 6 HNO3 → 3 Ca(NO3)2 + 2 H3PO4
2) Per via termica, partendo da fosforo elementare.
La sintesi dell'acido fosforico viene realizzata per ossidazione diretta del fosforo nei forni a tino o nei forni elettrici e susseguente idratazione.
Struttura a puntini di Lewis dell'acido fosforico
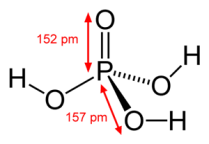
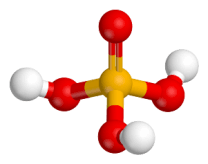
Struttura 3D
Usi dell'acido fosforico
L'impiego maggiore dell'acido fosforico si ha nella preparazione di fertilizzanti; in genere buona parte dell'acido prodotto col processo ad umido (circa l'80%) trova impiego in questo settore. Tuttavia anche notevoli quantità di acido fosforico per idratazione sono oggi impiegate nella preparazione dei fertilizzanti, soprattutto in U.S.A.
L'acido fosforico trova impiego anche nel campo della produzione dei sali di sodio e di calcio e nell'industria alimentare; grazie anche al suo gusto particolare, vicino a quello degli acidi citrico o tartarico, è usato nella preparazione di bevande; trova applicazione nella preparazione di sciroppi, nell'industria conserviera ed in altre industrie alimentari.
Vernici antiruggine per superfici metalliche sono formate da acido fosforico; piccole percentuali di fosfati di metalli pesanti sono impiegati nel cosiddetto processo di fosfatazione.
L'acido fosforico trova impiego nell'industria tessile, sia nella preparazione di ignifuganti per cotone, sia in alcuni procedimenti di tintura o di finissaggio di fibre di seta, di cotone e di canapa.
L'acido fosforico trova talvolta impiego nell'industria della gomma, in quella del vetro, nella preparazione di cementi dentari ed in numerose altre applicazioni.
È sovente usato come catalizzatore, adsorbito su base inerte, in numerose reazioni industriali.
Studia con noi