Anidride solforica
Proprietà e caratteristiche dell'anidride solforica
La anidride solforica, nota anche come triossido di zolfo è una sostanza con formula chimica SO3.
Esiste in tre forme:
- forma α;
- forma β;
- forma γ.
Mentre le prime due sono solide, la terza in condizioni standard è un liquido.
Poiché l'umidità, anche in tracce, favorisce la formazione di polimeri solidi, per la manipolazione dell'anidride solforica liquida si devono aggiungere inibitori di polimerizzazione, in genere derivati del boro, quali BF3, BCl3 e B2O3.
Proprietà chimiche e fisiche dell'anidride solforica
Alla temperatura ordinaria l'anidride solforica polimerizza in una massa bianca di cui esistono tre modificazioni:
α-SO3: è costituita da molecole S3O9; presenta un punto di fusione di 62,2°C; è di aspetto fibroso stratificato. Si prepara distillando sotto vuoto la forma γ ad una temperatura di 15-25°C e condensando i vapori con aria liquida. È la forma meno reattiva.
β-SO3: è formata da lunghe catene che terminano con gruppi OH; presenta una densità di 1,97 g/cm3, temperatura di fusione di 32,5°C. È di aspetto fibroso, simile all'asbesto. Si prepara dalla forma γ per lenta trasformazione in presenza di umidità e condensando i vapori di SO3 a -180°C.
γ-S03: è costituita da molecole semplici SO3; presenta una densità di 1,995 g/cm3, con punto di fusione di 16,8°C; ha una forma simile al ghiaccio e si prepara per solidificazione del liquido. È la forma più reattiva. Tale forma monomera S03 è in equilibrio con la forma trimera.
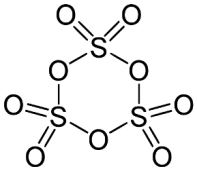
Forma trimera del γ-S03
L'anidride solforica liquida distilla senza dissociarsi alla pressione normale a 44,8°C; i vapori di SO3 sono stabili fino a 1000°C in assenza di corpi che agiscono da catalizzatori; in presenza di platino la dissociazione in SO2 e 02 incomincia poco sopra 400°C.
Fuma fortemente all'aria ed esercita un'energica azione disidratante su molte sostanze organiche, carbonizzandole.
L'anidride solforica si combina con l'acqua reagendo energicamente e formando acido solforico:
SO3 + H2O → H2SO4
Sotto l'azione delle scariche elettriche si combina con l'ossigeno formando l'anidride S207.
Alla temperatura ordinaria l'anidride solforica non attacca il ferro ed il nichel compatti.
Si combina con gli acidi alogenidrici:
SO3 + HCl → HSO3Cl
Reagisce con l'idrogeno solforato gassoso con formazione di zolfo, acqua ed anidride solforosa. Non reagisce con l'idrogeno solforato liquido.
Con i composti aromatici agisce come solforante e come tale viene usata nella solfonazione del benzene e nell'industria.
Sintesi ed usi dell'anidride solforica
La sintesi industriale dell'anidride solforica si ottiene per ossidazione dell'anidride solforosa ottenuta a sua volta dalla combustione dello zolfo con l'ossigeno atmosferico ad alta temperatura ed in presenza di opportuni catalizzatori (pentossido di vanadio V2O5 o platino).
L'applicazione princiaple dell'SO3 riguarda la produzione dell'acido solforico e dell'oleum.
Link correlati:
Quali sono i numeri di ossidazione dello zolfo?
Studia con noi