Pirrolo
Proprietà e caratteristiche del pirrolo
Il pirrolo, noto anche con il nome di azolo, è un composto aromatico eterociclico formato da quattro atomi di carbonio ed uno di azoto legati in un anello a cinque atomi.; ha formula bruta C4H5N e presenta la seguente struttura:
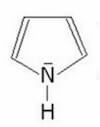
Ha massa molare di 67,09 g/mol, punto di fusione di -24°C, punto di ebollizione di 130°C e densità di 0,97 g/cm3.
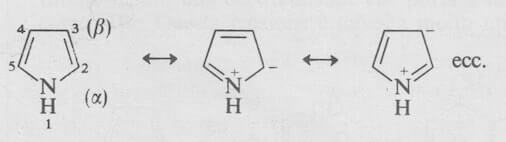
Il pirrolo è un liquido oleoso, incolore, presente nel catrame di carbone fossile; possiede caratteristiche aromatiche in quanto anche il doppietto elettronico dell'atomo di azoto partecipa con i quattro atomi di carbonio alla formazione del sestetto elettronico delocalizzato e pertanto la struttura del pirrolo rispetta la regola di Huckel.
A causa di questo comportamento, il doppietto elettronico non è più disponibile per esibire un comportamento basico.
Il sistema di numerazione e le forme di risonanza principali del pirrolo sono le seguenti:
Chimica del pirrolo
Il pirrolo ha una energia di coniugazione di 21 kcal/mole, il che lo rende più simile al furano che non al tiofene per quel che riguarda la reattività.
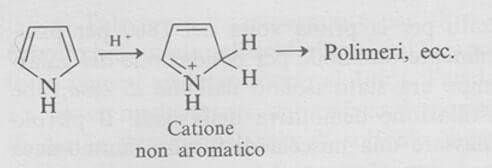
Analogamente al furano il pirrolo può venir protonato dagli acidi minerali acquosi per dare un catione reattivo che non è più aromatico e che forma facilmente polimeri. D'altra parte il pirrolo non viene protonato così facilmente come una ordinaria ammina aromatica o alifatica.
Il pirrolo è praticamente neutro perché la coppia di elettroni non condivisa sull'atomo di azoto è in realtà altamente delocalizzata poiché fa parte del sestetto aromatico della molecola. Come conseguenza il pirrolo non reagisce con gli alogenuri alchilici per dare i sali quaternari.
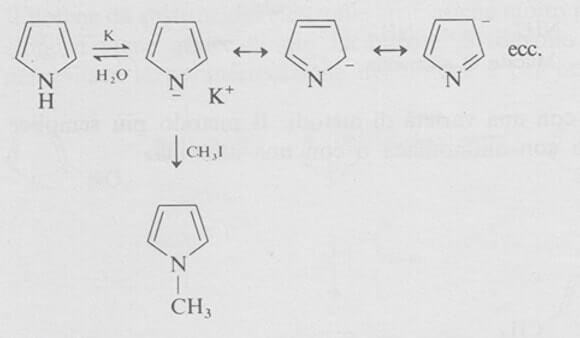
Il pirrolo ha proprietà anfotere. Non solo è una base debole (pKa = 0,4 per la formazione del catione) ma è anche un acido molto debole. Infatti il pirrolo reagisce con il potassio metallico per dare un composto ionico di potassio.
L'anione pirrolo, che è molto stabilizzato per risonanza, è un reattivo nucleofilo. Ad esempio reagisce rapidamente con ioduro di metile per dare il composto 1-metilpirrolo.
A causa della bassa acidità del pirrolo (pKa = 16,5) l'anione viene idrolizzato a pirrolo dall'acqua.
Il pirrolo non dà la reazione di Diels-Alder e neanche i suoi derivati in genere la danno, anche se si conoscono poche eccezioni isolate a questa regola.
Il pirrolo è estremamente reattivo alla sostituzione elettrofila e la sua reattività è paragonabile a quella dei fenoli e delle aniline.
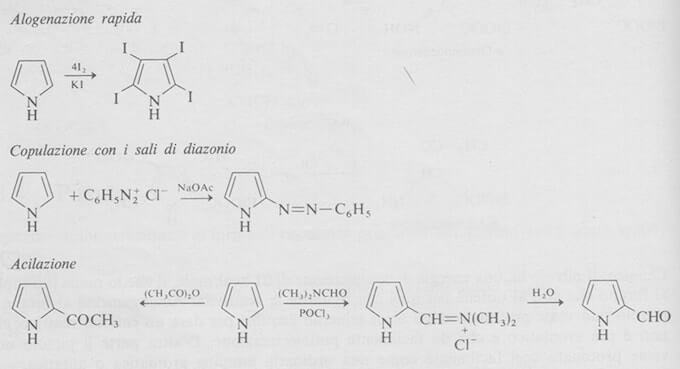
Ad esempio reagisce rapidamente con iodio per dare il tetraiodiopirrolo (si veda immagine seguente); dà reazioni di copulazione con i sali di diazonio e dà la reazione di Friedel-Crafts con anidride acetica, in assenza di catalizzatore.
Una reazione importante della chimica del pirrolo è l'introduzione diretta di un gruppo aldeidico con il metodo di Vilsmeier-Haack.
Come nel furano e nel tiofene la posizione α del pirrolo è quella che viene attaccata più facilmente dagli elettrofili.
Sintesi del pirrolo
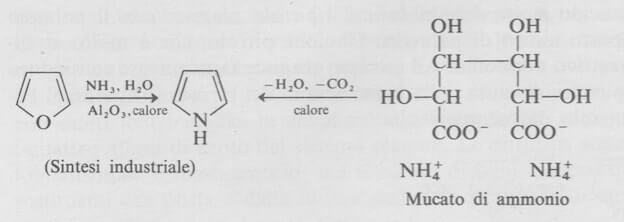
Il pirrolo è stato sintetizzato per la prima volta nel 1860 per pirolisi del sale di ammonio dell'acido mucico (facilmente ottenibile per ossidazione del galattosio).
Anche prima di questo tempo era stato isolato dall'olio di ossa, una miscela complessa di prodotti formati per distillazione demolitiva delle ossa.
Il pirrolo viene ora preparato industrialmente facendo passare una miscela di furano, ammoniaca e vapore acqueo su allumina rovente.
I pirroli sostituiti sono stati preparati con una varietà di metodi. Il metodo più semplice utilizza la reazione degli 1,4-dichetoni con ammoniaca o con una ammina.
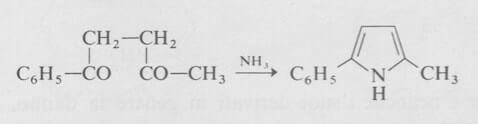
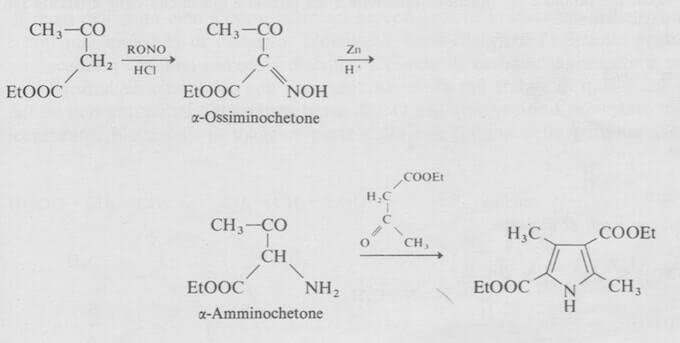
Un'altra sintesi molto usata, dovuta a Knorr, usa la condensazione di un composto ß-dicarbonilico con un α-amminochetone.
Uno dei vantaggi della sintesi di Knorr è che permette la costruzione dell'anello pirrolico partendo da due unità più piccole.
Poiché gli α-amminochetoni sono generalmente instabili e danno delle autocondensazioni vengono di solito preparati direttamente nella miscela di reazione per riduzione dei corrispondenti α-ossiminochetoni.
Pirroli esistenti in natura
Pochi pirroli esistono in natura, ma certi composti formalmente derivabili dal sistema pirrolico sono di importanza biochimica molto grande.
La struttura dell'anello pirrolico la si si ritrova in composti naturali quali le porfirine, la clorofilla, in numerosi alcaloidi naturali (come per esempio la nicotina) e nelle molecole dell'emoglobina.
Link correlati:
Che cosa sono gli azoli?
Proprietà e caratteristiche della pirocatechina
Che cosa sono i mannani?
Studia con noi