Insulina
Proprietà e caratteristiche dell'insulina
L'insulina è un ormone coinvolto in diverse funzioni metaboliche; essa è nota, in particolare, per la capacità di ridurre la glicemia (concentrazione di glucosio nel sangue).
Il glucagone è l'ormone antagonista dell'insulina.
Biosintesi e degradazione dell'insulina
L'insulina è una proteina a bassa massa molare (circa 5800 g/mol).
Essa è costituita da due catene polipeptidiche. La catena A è costituita da 21 amminoacidi, mentre la catena B è formata da 30 residui; esse sono unite per mezzo di due ponti disolfuro.
Il gene che codifica per l'insulina si trova nel braccio corto del cromosoma 11.
L'insulina è sintetizzata nel pancreas, precisamente dalle cellule β, che costituiscono il 60% delle cellule presenti nell'organo e si trovano all'interno delle isole di Langerhans.
Le cellule β producono inizialmente la preproinsulina (o peptide leader), costituita da 104 amminoacidi e che possiede una sequenza segnale all'estremità N-terminale.
Tale porzione della proteina è necessaria per il trasporto all'interno delle vescicole del reticolo endoplasmatico, dove essa viene rimossa (con taglio proteolitico) per formare la proinsulina, costituita da 81 amminoacidi e 3 ponti disolfuro. La proinsulina viene immagazzinata nei granuli di secrezione.
Quando è richiesta l'insulina (in condizioni di elevata glicemia), la proinsulina viene convertita in insulina, mediante rimozione del peptide C, il segmento intermedio della proinsulina, nell'apparato di Golgi.
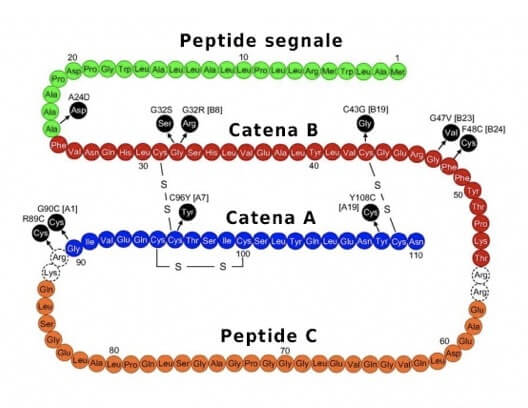
Struttura della preproinsulina. Sono presenti le due catene A e B dell'insulina, il peptide segnale, all'estremità N-terminale, che viene rimosso durante la conversione da preproinsulina a proinsulina, e il peptide C, che viene rimosso durante la conversione da proinsulina a insulina.
L'insulina ha una vita media di 7-15 minuti, dopo i quali viene inattivata nel fegato per mezzo dell'enzima glutatione-insulina trans-idrogenasi, che catalizza la rottura dei ponti disolfuro.
Le catene A e B, così separate, vengono degradate dalle proteasi lisosomiali insulinasi.
Funzioni dell'insulina
L'insulina, come già detto, svolge numerose funzioni all'interno dell'organismo:
- Riduce la glicemia (effetto ipoglicemizzante), favorendo la rimozione del glucosio dal sangue, dal quale viene trasferito alle cellule, dove viene utilizzato.
- Stimola la produzione energetica a partire dal glucosio, favorendo quei processi come la glicolisi.
- Inibisce la gluconeogenesi, cioè la sintesi di glucosio a partire da altre molecole organiche, come gli amminoacidi gluconeogenici.
- Stimola la glicogenosintesi, cioè la sintesi del glicogeno, nel fegato. (Il glicogeno è il polisaccaride del glucosio, che ha funzione di riserva e può essere utilizzato dalle cellule in caso di necessità).
- Inibisce la glicogenolisi, (la scissione del glicogeno nelle unità monomeriche di glucosio), il processo metabolico inverso della glicogenosintesi.
- Stimola il passaggio degli amminoacidi dal sangue alle cellule, analogamente alla funzione che svolge nei confronti del glucosio.
- Stimola la sintesi proteica (funzione anabolizzante).
- Riduce la concentrazione di acidi grassi nel sangue, favorendo la rimozione degli acidi grassi dal sangue, dal quale essi vengono trasferiti alle cellule, dove vengono utilizzati.
- Favorisce la sintesi di acidi grassi a partire da glucosio e amminoacidi in eccesso.
- Inibisce la lipolisi (scissione degli acidi grassi per ottenere energia).
- Favorisce la sintesi del colesterolo.
- Stimola la proliferazione cellulare.
- Favorisce l'ingresso nella cellula di ioni potassio, magnesio e fosfato.
Meccanismo d'azione dell'insulina
Il rilascio di insulina avviene in funzione della glicemia. Quando il glucosio è presente nel sangue in concentrazione elevata, il trasportatore del glucosio GLUT2, ne permette l'ingresso nelle cellule β.
Qui esso viene fosforilato e convertito in glucosio-6-fosfato ed entra nella glicolisi, che porta, dopo diverse tappe metaboliche, alla sintesi di ATP, che inibisce l'apertura dei canali al potassio ATP-dipendenti della membrana plasmatica.
Il ridotto passaggio di ioni potassio causa l'apertura dei canali per il calcio, che porta al rilascio dell'insulina per esocitosi.
L'insulina lega il recettore dell'insulina, un recettore transmembrana costituito da 4 subunità, due α e due β, unite tramite ponti disolfuro.
Le subunità α costituiscono la porzione extracellulare del recettore, mentre le subunità β sono transmembrana.
I recettori dell'insulina sono presenti prevalentemente nel fegato, nei muscoli striati e nel tessuto adiposo, i tessuti maggiormente sensibili agli effetti dell'ormone.
L'insulina si lega alle subunità alfa. Ciò determina un cambiamento conformazionale delle subunità β che si avvicinano, si autofosforilano e vengono attivate. Le subunità fosforilate fosforilano altri enzimi intracellulari.
Tra questi enzimi, viene attivata la proteina IRS1 (substrato del recettore dell'insulina), che attiva un altro enzima, PI3-K (fosfoinositide-3-chinasi), che invia un segnale ai trasportatori del glucosio GLUT-4, che determinano l'ingresso del glucosio nella cellula.
PI3-K, inoltre, può, a sua volta, innescare la via metabolica di Akt/mTOR, che, tra le altre funzioni, determina un aumento della proliferazione cellulare.
Oltre ad avere questi effetti, diretti e immediati, l'insulina svolge le sue azioni anche agendo a livello genetico e, in particolare, sui meccanismi di trascrizione e traduzione di DNA e RNA, influenzando così la sintesi di enzimi e trasportatori coinvolti nei diversi processi metabolici.
Il recettore dell'insulina ha una vita media di 7 ore. Dopo questo tempo, il complesso insulina-recettore viene degradato nei lisosomi.
Insulina e diabete
Il diabete è una patologia caratterizzata da elevata glicemia causata da una carenza di insulina o da una scarsa sensibilità dell'organismo all'ormone.
Esistono numerose forme di diabete, ma le più comuni sono il diabete mellito di tipo 1 e 2.
Il diabete mellito di tipo 1 è definito una malattia autoimmune, perché è causato dalla distruzione, da parte del sistema immunitario (linfociti T e macrofagi), delle cellule β-pancreatiche. In queste condizioni, l'organismo non può produrre insulina.
Le cause di questa patologia possono essere genetiche o ambientali.
Invece, il diabete mellito di tipo 2, la forma più frequente di diabete, è dovuto sia a una scarsa produzione di insulina, sia alla cosiddetta insulino-resistenza, ovvero una ridotta sensibilità delle cellule nei confronti degli effetti dell'insulina.
Anch'esso può essere causato da predisposizione genetica o fattori ambientali.
L'insulina viene impiegata per trattare il diabete mellito di tipo 1, ma non quello di tipo 2, poiché quest'ultima patologia è causata da una ridotta capacità dell'organismo di rispondere all'ormone.
Esistono diversi tipi di insulina per il trattamento farmacologico del diabete:
- ultrarapida (gli effetti iniziano entro 15 minuti, il picco si ha entro un'ora e ha una durata d'azione fino a 4 ore);
- rapida (gli effetti iniziano entro 30 minuti, il picco si ha entro 4 ore e ha una durata d'azione fino a 8 ore);
- semilenta (gli effetti iniziano entro 2 ore, il picco si ha entro 5 ore e ha una durata d'azione fino a 12 ore);
- NpH (Neutral protamine Hagedorn; l'azione inizia entro 4 ore, il picco si verifica entro 8 ore e ha una durata d'azione fino a 15 ore);
- lenta (l'azione inizia entro 2 ore, il picco si ha entro 12 ore e ha una durata d'azione fino a 24 ore);
- ultralenta (l'azione inizia entro 6 ore, il picco si ha entro 15 ore e ha una durata d'azione fino a 24 ore);
- Glargine (l'azione inizia entro 6 ore, il picco non si verifica e ha una durata d'azione di oltre 24 ore).
Link correlati:
Che cosa è la creatina?
Studia con noi