Metanolo
Proprietà e caratteristiche del metanolo
Il metanolo o alcol metilico è un composto organico con formula chimica CH3OH.
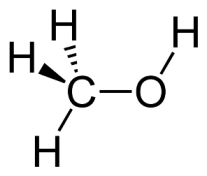
Si presenta come un liquido incolore e dall'odore caratteristico; bolle a 64,96°C ed è solubile in acqua in tutte le proporzioni.
Fu scoperto nel 1661 da Robert Boyle tra i prodotti della distillazione secca del legno e fu denominato dal chimico inglese "adiaphorous spirit"; in seguito fu detto spirito di legno. La composizione chimica venne stabilita da Dumas e Peligot.
L'acol metilico si trova in vari olii essenziali sotto forma di etere e di estere; è stato riscontrato anche allo stato libero, ma in piccole quantità, in alcune foglie e frutti, probabilmente a causa di processi di scissione idrolitica durante l'estrazione o la conservazione.
Proprietà chimice del metanolo
Il metanolo ha il comportamento degli alcoli primari: tanto per ossidazione che per deidrogenazione si trasforma in aldeide formica e per idrogenazione in metano e acqua.
Reagisce con l'acqua a 250°C in presenza di rame formando CO2 e 3 H2.
In presenza di agenti disidratanti (acido solforico concentrato, acido fosforico, anidride borica) a 160°C forma etere dimetilico; lo stesso prodotto viene ottenuto facendo passare vapori di alcol metilico su allumina a 300-400°C.
Il metanolo dà con i metalli alcalini i corrispondenti alcolati, sviluppando idrogeno. Ad esempio:
2 CH3OH + 2 Na → 2 CH3O− + 2 Na+ + H2
Azione fisiologica del metanolo
Il metanolo è velenoso e la sua manipolazione richiede misure di protezione particolari. È un veleno cellulare e produce lesioni in vari organi (fegato, cuore); agisce sul sistema nervoso e sulla retina.
La sua presenza nelle bevande alcoliche è da escludere in modo assoluto, per quanto in Italia sia tollerato in tracce nell'alcol di 2a categoria.
Sintesi del metanolo
Fino ad alcuni decenni fa l'alcol metilico veniva ottenuto nell'industria della distillazione secca del legno, insieme all'acido acetico; attualmente tale industria ha perduto molta della sua importanza e sopravvive solo in pochi paesi ricchi di foreste.
L'industria del metanolo è ora fondata sull'idrogenazione catalitica dell'ossido di carbonio, secondo la reazione:
CO + 2 H2 → CH3OH
Questa reazione è esotermica e dovrebbe condursi a bassa temperatura; poiché però a bassa temperatura diminuisce la velocità di reazione, occorre cercare il giusto compromesso cinetico-termodinamico che consenta la massima resa nell'unità di tempo.
La resa della reazione precedente può diminuire per la formazione di metano in base alle reazioni:
CO + 3 H2 → CH4 + H2O
2 CO+ 2 H2 → CH4 + CO2
CH3OH + H2 → CH4 + H2O
2 CH3OH → CH4 + CO2 + 2 H2
Si forma inoltre fino al 4% di etere dimetilico, secondo la reazione:
2 CH3OH → CH3-O-CH3
Questa reazione viene limitata sostituendo circa ¼ di CO con CO2.
Queste reazioni parassite sono influenzate dalla composizione del gas di sintesi, dalla temperatura, pressione e natura del catalizzatore; con un catalizzatore misto appropriato esse si possono limitare al minimo, mentre sono favorite da temperature elevate.
Il metanolo si può ottenere sinteticamente anche da CO2 + H2, in base alla reazione di equilibrio:
CO2 + 3 H2 ⇄ CH3OH + H2O
La reazione può essere accompagnata dalle seguenti reazioni parassite:
CH3OH + H2 → CH4 + H2O
2 CH3OH → CH4 + CO2 + 2 H2
CO2 + 4 H2 → CH4 + 2 H2O
Nel 1936 in Canada fu messo a punto un procedimento per la produzione di metanolo in base alla reazione seguente:
CH4 + ½ O2 → CH3OH
Le caratteristiche del processo canadese sono: temperatura 400-500°C, pressione 170-200 atm, catalizzatore a base di rame.
Usi del metanolo
Il metanolo viene impiegato per la sintesi della formaldeide, del metacrilato, di metilammine, di dimetiltereftalato, di alogenuri di metile e di altri prodotti chimici.
Altri usi sono : come antigelo e come solvente.
Ti potrebbe interessare: tasso alcolemico.
Studia con noi