Reazioni Chimiche
Generalità e proprietà delle reazioni chimiche
Le reazioni chimiche della materia (dette anche trasformazioni chimiche) sono trasformazioni irreversibili nelle quali si ha la formazione di nuove sostanze; sono trasformazioni che interessano la natura delle particelle delle sostanze, modificandole e consentendo pertanto la formazione di nuove sostanze.
Si ha una reazione chimica per esempio quando lo zucchero viene sottoposto a riscaldamento; inizialmente lo zucchero fonde e poi, prolungando il riscaldamento, lo zucchero scompare, formando due sostanze nuove: acqua e carbonio.
Si sono formate nuove sostanze e la trasformazione è irreversibile in quanto una volta che è avvenuta non può più procedere in senso inverso. Anche la formazione della ruggine dal ferro è un esempio di reazione chimica:
Per descrivere una reazione si utilizzano equazioni chimiche nelle quali i reagenti vengono scritti a sinistra di una freccia, mentre a destra vengono scritti i prodotti:
![]()
La freccia indica che i reagenti si trasformano nei prodotti. Supponendo che i reagenti siano due, indicati come A e B, e che diano luogo a due prodotti, C e D, si chiama equazione di reazione l'espressione:
![]()
nella quale a, b, c, d sono i coefficienti stechiometrici che indicano in quali rapporti (in moli) entrano in reazione i reagenti e si formano i prodotti.
Talora alla reazione di A e B per dare C e D si oppone la reazione inversa di C e D per dare A e B, e il sistema delle due reazioni opposte è indicato indicato come segue:

In questi casi né la reazione diretta, né l'inversa possono svolgersi con completa trasformazione dei reagenti a prodotti, perché il sistema tende a uno stato di equilibrio in cui tutti i componenti (A, B, C e D) sono presenti.
Una reazione si dice omogenea quando avviene entro un'unica fase, che può essere una miscela gassosa, una soluzione liquida, o una soluzione solida; è invece eterogenea se avviene tra due o più fasi diverse, per esempio nell'attacco di un solido da parte di un gas o nella reazione tra due liquidi immiscibili.
Evidenze sperimentali delle reazioni chimiche
I fenomeni più frequenti che si manifestano durante una reazione chimica sono:
- comparsa o scomparsa di un solido (es. aspirina nell'acqua; formazione delle stalattiti)
- cambiamento di colore (es. formazione della ruggine, mela che marcisce)
- formazione di bollicine (es. aspirina nell'acqua)
- riscaldamento o raffreddamento spontaneo dell'ambiente in cui è stata fatta avvenire la reazione (esempio: combustione)
Esempi di reazioni chimiche
Esempi di reazioni chimiche sono: cottura di un uovo, combustione della benzina, mela che marcisce, formazione della ruggine, preparazione del caramello dal riscaldamento dello zucchero.
Le reazioni chimiche obbediscono a leggi ben precise note come leggi ponderali, cioè relative al peso delle sostanze, che sono considerate i pilastri fondamentali della chimica. Queste sono: la legge di Lavoisier, la legge di Proust e la legge di Dalton.
Discorso diverso meritano le trasformazioni fisiche della materia.
Condizioni necessarie affinché avvenga una reazione chimica
Come spiegato dalla teoria degli urti, affinché abbia luogo una reazione chimica devono verificarsi le seguenti condizioni:
- che le molecole dei reagenti urtino tra loro;
- che le particelle durante l'urto abbiano una orientazione corretta;
- che l'urto sia sufficientemente energetico.
Se solo una di queste condizioni non si verificata, la reazione chimica non avviene.
Profilo energetico di una reazione chimica
I reagenti chimici, prima di trasformarsi nei prodotti, passano attraverso lo stato di transizione del sistema reagente. Tale stato, che rappresenta un massimo di energia, corrisponde al momento della reazione in cui i reagenti si stanno trasformando nei prodotti e si ha la formazione del complesso attivato.
Per raggiungere lo stato di transizione, i reagenti - durante la collisione delle molecole - devono avere una energia superiore ad una soglia minima nota come energia di attivazione.
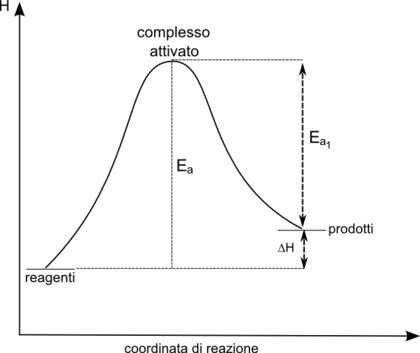
La differenza tra l'energia dei prodotti e l'energia dei reagenti (simboleggiata con ΔH) corrisponde al calore assorbito o ceduto durante la reazione stessa.
Come velocizzare una reazione chimica
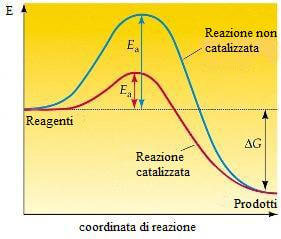
Allo scopo di velocizzare una reazione chimica si può ricorrere all'uso di catalizzatori, cioè di sostanze che rendono possibile il suo svolgimento in due o più stadi veloci, in sostituzione del cammino di reazione più lento della reazione non catalizzata. I catalizzatori abbassano il valore dell'energia di attivazione e quindi velocizzano la reazione.
Altro fattore di fondamentale importanza nel determinare la velocità di una reazione chimica è la temperatura, in quanto la velocità delle reazioni ordinarie cresce con essa.
Tipi di reazioni chimiche
A seconda del modo in cui i reagenti si combinano tra loro per formare i prodotti, si possono avere quattro tipi diversi di reazioni chimiche:
Sono quelle reazioni nelle quali da due o più reagenti si viene a formare un unico prodotto; sono schematizzate nel seguente modo: A + B → C
Sono quelle reazioni nelle quali da un unico reagente si vengono a formare due o più prodotti; sono schematizzate nel seguente modo: A → B + C
Dette anche di sostituzione o di spostamento, in queste reazioni un elemento libero (A) sostituisce e prende il posto di un elemento (B) presente nel composto (BC); sono schematizzate nel seguente modo A + BC → AC + B e comportano una variazione del numero di ossidazione.
Sono quelle reazioni chimiche in cui due composti (AB e CD) si scambiano i "partner"; sono schematizzate nel seguente modo: AB + CD → AD + CB
Link correlati:
Tool online per il bilanciamento online di reazioni chimiche
Qual è la differenza tra fenomeni fisici e chimici?
Esercizi online sul bilanciamento di reazioni chimiche
Studia con noi