Anilina
Proprietà e caratteristiche dell'anilina
L'anilina, noto anche come amminobenzene, fenilammina o benzenammina, è un composto chimico con formula bruta C6H7N.
Viene chiamata in questo modo perché ottenuta per la prima volta nel 1826 dall'anil, nome spagnolo dell'indaco.
Appartiene alla famiglia delle ammine; presenta la seguente struttura:
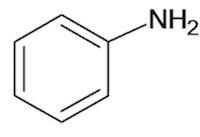
Struttura chimica dell'anilina.
È la più semplice tra le ammine aromatiche. Ha massa molare di 93,13 g/mol, punto di fusione di -6,2°C, punto di ebollizione di 184°C e densità pari a 1,03 g/cm3.
Si presenta come un liquido incolore, oleoso, che imbrunisce all'aria; è tossica se ingerita o inalata.
È un composto di carattere debolmente basico; la sua basicità è inferiore a quella della cicloesilammina. Ciò è dovuto alla risonanza tra la coppia solitaria di elettroni presente sull'atomo di azoto e l'anello aromatico:
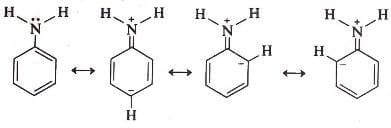
Tale risonanza rende meno disponibile la coppia di elettroni presente sull'atomo di azoto ad essere condivisa e pertanto l'anilina si comporta come una debole base di Lewis.
Dati sperimentali dimostrano che ha una basicità che è un milione di volte inferiore a quella della cicloesilammina.
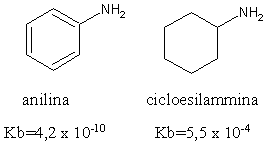
Come conseguenza dell'effetto di risonanza appena descritto si ha che la molecola di anilina ha un eccesso di elettroni disponibili per l'anello aromatico e quindi è molto reattiva rispetto agli elettrofili.
Nelle reazioni di sostituzione elettrofila aromatica il gruppo amminico della anilina si comporta quindi come attivante e orto-para orientante.
L'anilina forma con gli acidi dei sali stabili solubili in acqua che danno idrolisi acida; forma un azeotropo con il glicole propilenico.
Numerose sono le reazioni cromatiche, impiegabili anche a scopo analitico:
- con ipoclorito di calcio si ha colorazione violetta (saggio di Runge);
- con acido acetico e furfurolo si ha colorazione rossa;
- con bicromato potassico e acido solforico si ottiene una caratteristica tonalità verde-azzurra.
Preparazione industriale dell'anilina
Inizialmente l'anilina si otteneva dai prodotti di distillazione del catrame di carbon fossile, dove è presente in piccola quantità.
Oggigiorno l'anilina può essere preparata industrialmente sfruttando diversi procedimenti, i più importanti dei quali sono i seguenti:
1) riduzione del nitrobenzene con idrogeno prodotto in situ dalla reazione di ferro con acido cloridrico acquoso (metodo Béchamp). Come sottoprodotti della reazione si formano cloruro ferroso e acqua.
La reazione può essere schematizzata nel seguente modo:
C6H5NO2 + 3Fe + 6HCl → C6H5NH2 + 3FeCl2 + 2H2O
Nella pratica industriale si utilizza soltanto il 2% della quantità di HCl stechiometricamente richiesta dalla reazione. Ciò è dovuto al fatto che il cloruro ferroso contribuisce alla riduzione del nitrobenzene;
2) idrogenazione del nitrobenzene in fase gassosa alla temperatura di 200-350°C. In questo processo di riduzione il nitrobenzene miscelato con l'opportuna quantità di idrogeno viene fatto passare su catalizzatori a base di rame;
3) ammonolisi del clorobenzene con una soluzione concentrata di ammoniaca in presenza di catalizzatori a base di sali rameosi.
La reazione viene fatta avvenire sotto pressione alla temperatura di circa 200-250°C:
C6H5-Cl + NH3 → C6H5-NH2 + HCl
4) ammonolisi del fenolo (acido fenico) su catalizzatore di ossido di vanadio su un supporto di allumina-silice.
La reazione viene fatta avvenire a temperature di circa 400-500°C:
C6H5-OH + NH3 → C6H5-NH2 + H2O
Preparazione in laboratorio
In un pallone da un litro munito di un refrigerante a cadere, si mettono 45 g di stagno granulare e poi si aggiungono 25 g di nitrobenzene quindi, agitando, 10-15 mL di acido cloridrico concentrato.
La miscela si scalda all'ebollizione; inizia così una violenta reazione, che non appena cessa si riattiva aggiungendo altro acido cloridrico fino a raggiungere un totale di 125 ml.
La reazione si modera raffreddando il pallone con acqua.
La soluzione contenente il clorostannato di anilina, si tratta con idrato sodico, fino a che il precipitato, formatosi in un primo tempo, non sia nuovamente passato in soluzione.
A questo punto si sottopone il liquido alla distillazione in corrente di vapore.
L'anilina che passa sotto la forma di un olio quasi incolore, si separa in imbuto separatore: un'altra porzione si può ricavare estraendo le acque madri con etere etilico.
L'etere si evapora e il residuo assieme alla prima porzione di anilina precedentemente separata si rettifica raccogliendo le frazioni bollenti tra 180 e 184°C.
Impieghi dell'anilina
L'anilina, divenne un prodotto commercialmente importante solo nel 1856, quando il chimico inglese W. Perkin se ne servì come materia prima per preparare il primo colorante sintetico, la mauveina.
Oggigiorno l'anilina trova impiego nei seguenti campi:
- dei coloranti artificiali;
- dei medicinali;
- di ausiliari per l'industria della gomma;
- di resine sintetiche utilizzate in apparecchiature elettriche.
L'anilina viene inoltre impiegata come propellente, come stabilizzante per esplosivi, nella lavorazione petrolio e come reattivo in chimica analitica.
Link correlati:
Proprietà e caratteristiche dell'anisolo
Formula di struttura del 2-metilesano
Studia con noi