Bicromato di potassio
Proprietà e caratteristiche del bicromato di potassio
Il bicromato di potassio è un sale ternario con formula chimica K2Cr2O7.
È un composto che forma cristalli triclini rosso-aranciati.
A 236,8 °C si trasforma in una modificazione monoclina che a 398 °C fonde in un liquido rosso-scuro.
Al disopra di 610°C si decompone in cromato, ossido di cromo ed ossigeno.
4K2Cr2O7 → 4K2CrO4 + 2Cr2O3 + 3O2
In soluzione acquosa cromato di potassio e bicromato di potassio sono in equilibrio:
2 CrO42− + 2 H3O+ ⇄ Cr2O72− + 3 H2O
In base al principio di Le Chatelier, in soluzione acida prevarrà l'anione bicromato, mentre in soluzione basica prevarrà l'anione cromato.
Il cromato di potassio è quindi un composto solubile in acqua che nel processo di dissoluzione si ionizza nel seguente modo:
K2Cr2O7(s) → 2 K+(aq) + Cr2O72−(aq)
Cr2O72− + 3 H2O ⇄ 2 CrO42− + 2 H3O+
La struttura del bicromato di potassio è la seguente:
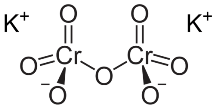
Come tutti i composti del cromo esavalente, anche il dicromato di potassio è un agente cangerogeno fortemente dannoso per la salute dell'uomo.

Bicromato di potassio
Preparazione del bicromato di potassio
Il metodo più usato per la preparazione del bicromato di potassio è attraverso la conversione del bicromato sodico in sale potassico con cloruro di potassio.
Usi del bicromato di potassio
Il bicromato di potassio viene sostituito dal bicromato sodico più economico; presenta però il vantaggio, rispetto a quest'ultimo, di non essere igroscopico e viene quindi impiegato nell'industria fotografica e nella fabbricazione dei fiammiferi di legno e dei fuochi artificiali.
Anche nella preparazione del giallo e del pigmento verde di zinco, si impiega il bicromato potassico, perché la presenza del potassio è importante.
Il dicromato di potassio viene inoltre utilizzato come agente ossidante in alcune reazioni della chimica organica. In pareticolare viene utilizzato nella ossidazione degli alcoli.
Link correlati:
Proprietà e caratteristiche del bicarbonato di ammonio
Studia con noi