Teoria di Lewis: estensione del concetto di acido-base
La teoria di Lewis sugli acidi e le basi afferma che: un acido è qualsiasi sostanza in grado di accettare una coppia di elettroni; una base è qualsiasi sostanza in grado di cedere una coppia di elettroni non condivisa.
Premessa
Nel 1923, il chimico fisico statunitense G. Lewis (Weymouth, Massachusetts, 1875 - Berkeley, California, 1946), formulò una teoria sugli acidi e le basi che rappresenta una ulteriore estensione del concetto di acido-base indicato nella teoria di Bronsted-Lowry.
Acidi e basi secondo Lewis
Un acido, secondo Lewis, è una sostanza in grado di accettare una coppia di elettroni; una base è, invece, una sostanza in grado di cedere una coppia di elettroni non condivisa.
La reazione tra una base di Lewis (:B) e un acido di Lewis (A) forma un addotto o complesso (B:A)
![]()
ovvero:

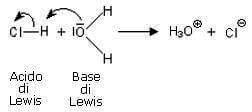
La reazione tra un acido e una base di Lewis viene rappresentata con frecce curve che partono dal doppietto elettronico della base e giungono all'orbitale vuoto dell'acido.
Per esempio, la reazione:
![]()
viene rappresentata nel seguente modo:
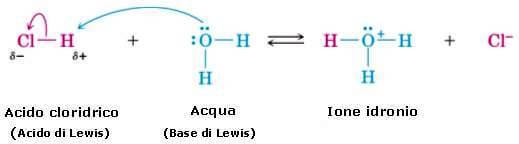
ovvero:
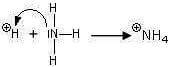
Mentre la reazione:
![]()
viene rappresentata nel seguente modo:
ovvero:
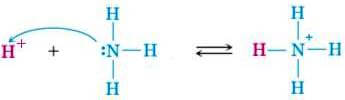
Le basi di Bronsted rientrano per definizione fra le basi di Lewis: infatti, secondo la teoria di Bronsted, una base è una sostanza che accetta (e quindi addiziona a sé) un protone; tale protone viene però legato per mezzo di una coppia di elettroni non condivisa (lone pair): ne consegue che una base di Bronsted è anche una base di Lewis.
Come rappresentato nella figura precedente, questo comportamento è mostrato, ad esempio, dall'ammoniaca, che lega un protone coordinandolo e formando lo ione ammonio NH4+.
Con più difficoltà si inquadrano gli acidi di Bronsted fra gli acidi di Lewis. Infatti HCl, H2SO4, CH3COOH sono molecole sature di elettroni che non hanno la possibilità di accettare una coppia di elettroni, e quindi non dovrebbero rientrare fra gli acidi di Lewis.
Essi possono però fornire protoni, e poiché il protone H+ è un acido di Lewis (infatti può accettare una coppia di elettroni), ne consegue che gli acidi di Bronsted possono farsi rientrare indirettamente fra gli acidi di Lewis.
Link correlati:
Quiz online su acidi e basi
Cosa afferma la teoria di Arrhenius?
Che cosa afferma la teoria di Bronsted-Lowry?
Che coso sono pH e pOH?
Studia con noi