Legame metallico
Il legame metallico, il modello a nube elettronica e la teoria delle bande
Gli atomi che costituiscono un metallo sono tenuti insieme da un tipo di legame chiamato legame metallico.
Tra i modelli che descrivono il legame metallico vi è il "modello a nube elettronica" di P. Drude (1863- 1906).
Vediamoli in dettagli entrambi.
Legame metallico: modello a nube elettronica
Secondo questo modello in un metallo gli atomi perdono i loro elettroni di valenza trasformandosi in cationi (ioni positivi). Gli ioni si dispongono in modo da impacchettarsi nel miglior modo possibile (massimo impaccamento), creando così strutture geometriche ben definite.
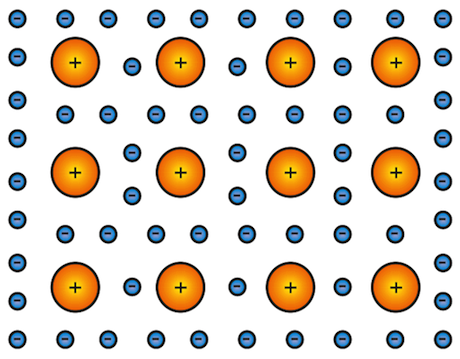
Legame metallico.
Gli elettroni di valenza non appartengono più ai singoli atomi, ma sono liberi di muoversi (elettroni delocalizzati) tra i vari cationi.
Possiamo quindi immaginare un cristallo metallico come costituito da un reticolo di ioni positivi immersi in un mare di elettroni che ne costituiscono l'elemento legante.
Questo modello spiega alcune proprietà caratteristiche dei metalli: sono buoni conduttori infatti gli elettroni sono liberi di muoversi all'interno del reticolo cristallino; sono duttili, cioè possono essere trasformati in fili sottili e sono malleabili (cioè possono essere ridotti in lamine) infatti gli elettroni mobili permettono agli ioni positivi del metallo di "scivolare" gli uni sugli altri, senza compromettere la compattezza della struttura.
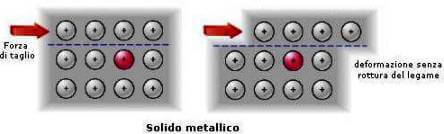
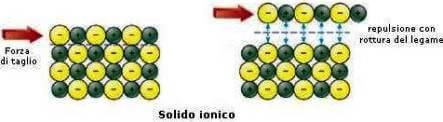
Il comportamento dei metalli è opposto a quello dei solidi ionici.
La fragilità dei solidi ionici è dovuta alla presenza in essi delle cariche positive e negative.
Una sollecitazione meccanica provoca lo scorrimento dei piani, perciò le cariche uguali vengono a contatto.
La notevole repulsione provoca la frattura.
Teoria delle bande
Una teoria più moderna che riguarda il legame metallico è la teoria delle bande.
Essa è in relazione con la teoria dell'orbitale molecolare e parte dal presupposto che gli orbitali atomici (AO) di ciascun atomo possano dare origine a orbitali molecolari (MO) con tutti gli altri atomi vicini. Partendo quindi da nAO si otterranno nMO estesi a tutto il cristallo.
Ogni obitale molecolare si trova in un particolare livello energetico e poiché i livelli sono molto numerosi e quindi estremamente vicini, danno origine a una banda continua di energia,in cui possiamo pensare che l'energia non sia quantizzata.
Questa bande possono rimanere separate o sovrapporsi parzialmete tra loro. Nella figura seguente è rappresentata la sovrapposizione parziale delle bande continue di energia 2s e 2p in un metallo:
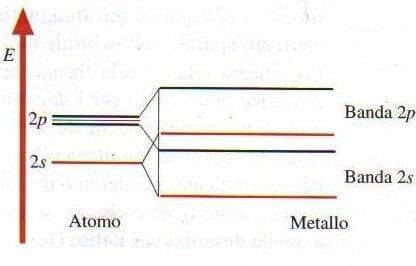
La conducibilità elettrica di molti metalli si può spiegare con un passaggio di elettroni eccitati attraverso il conduttore (per la presenza di un campo elettrico esterno) se nel metallo vi è una banda solo parzialmente occupata da elettroni o vi sono altre bande vuote, capaci di ospitare elettroni delocalizzati (promossi).
La teoria delle bande spiega anche la lucentezza metallica: gli elettroni presenti nel metallo, molto numerosi, assorbono tutte le lunghezze d'onda della luce, vengono "eccitati" e promossi su bande disponibili a energia maggiore. Riemettono, poi, i fotoni assorbiti quando tornano sulla banda originale.
In figura si vede come ponendo un cristallo di litio - che si trova nel suo stato fondamentale - in un campo elettrico, alcuni elettroni del cristallo assorbono energia sufficiente per poter occupare i livelli superiori della banda 2s, inizialmente vuoti.
Sono proprio questi elettroni accitati ad essere i responsabili della conduzione elettrica.
Quiz sui legami chimici
Se ti interessano li trovi qui: quiz sui legami chimici.
Link correlati:
Qual è la differenza tra legame covalente e ionico?
Studia con noi