Legami chimici
Come avviene la formazione dei legami chimici
Con il termine legame chimico si indicano globalmente le interazioni tra atomi che portano alla formazione di molecole o anche alla formazione di cristalli ionici o di cristalli di tipo metallico.
Tali interazioni riguardano principalmente gli elettroni più esterni degli atomi e producono modificazioni della struttura elettronica degli atomi.
I fondamenti della teoria elettronica del legame chimico si rifanno al modello di G.N.
Lewis secondo cui il legame interessa solo gli elettroni più esterni degli atomi: ogni atomo tende a completare gli orbitali del livello più esterno (e quindi ad avere 8 elettroni di valenza) sia assumendo o cedendo elettroni, sia mettendo elettroni in comune.
Ma una comprensione soddisfacente della natura dei legami chimici si ottiene solo con ipotesi che tengano conto della meccanica quantistica: queste teorie hanno avuto origine da due approcci distinti, il metodo del legame di valenza e il metodo degli orbitali molecolari.
Classificazione dei legami chimici
Esistono vari tipi di legami chimici:
Il legame covalente si forma tra atomi che hanno un alto valore di elettronegatività e quindi tra atomi "non metallici".
Esistono due tipi di legame covalente: il legame covalente puro e il legame covalente polare.
Il legame covalente puro (o covalente omeopolare) si realizza tra atomi dello stesso elemento.
Il legame covalente polare (o covalente eteropolare) si realizza tra atomi di elementi diversi (ma i due atomi devono avere una differenza di elettronegatività inferiore a 1,9).
In realtà esiste anche un particolare tipo di legame covalente chiamato legame dativo nel quale un atomo detto donatore o datore fornisce la coppia di elettroni di legame.
Tale coppia di elettroni viene condivisa con un atomo detto accettore.
Tale legame una volta formatosi non è distinguibile da un normale legame covalente.
Il legame ionico si realizza quando la differenza di elettronegatività fra i due elementi che intendono legarsi è superiore a 1,9.
Si verifica il trasferimento di uno o più elettroni dall'atomo meno elettronegativo all'atomo più elettronegativo.
Il legame metallico che tiene uniti gli atomi che costituiscono un metallo.
Legami intermolecolari
Oltre a quelli appena visti che sono legami intramolecolari, vi sono legami che tengono unite le varie molecole. Si parla in questo caso di legami intermolecolari.
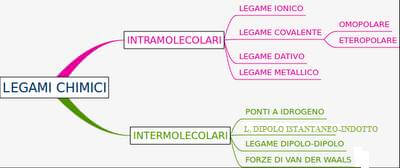
Classificazione dei legami chimici
Energia di legame
Si definisce energia di legame l'energia per mole necessaria a rompere un dato legame (allo stato gassoso). L'energia di legame si misura in Kcal/mol o in KJ/mol o in elettronvolt eV.
Altri tipi di legame
In chimica organica riveste un ruolo assai importante il legame peptidico che unisce il gruppo carbossilico e il gruppo amminico di due amminoacidi uguali o diversi.
Quiz sui legami chimici
Se ti interessano li trovi qui: quiz sui legami chimici.
Studia con noi