Idrossidi
Idrossidi: nomenclatura tradizionale e IUPAC
Gli idrossidi si formano sommando una o più molecole d'acqua ad un'ossido:
Ossido + nH2O → Idrossido
e hanno formula generale Me(OH)n in cui:
Me = simbolo chimico del metallo
n = numero di ossidazione del metallo.
In altre parole per la formula chimica di qualsiasi idrossido si ottiene scrivendo il simbolo del metallo Me e, di seguito, un numero di gruppi OH pari al numero di ossidazione del metallo.
Per esempio, dato l'alluminio Al avente numero di ossidazione 3+, la formula del suo idrossido è: Al(OH)3.
Negli idrossidi è presente il gruppo OH−, che viene chiamato ossidrile e che si può pensare originato da una molecola di acqua in seguito a perdita di uno ione H+.
Negli idrossidi la carica dello ione OH− viene annullata dalla carica del metallo.
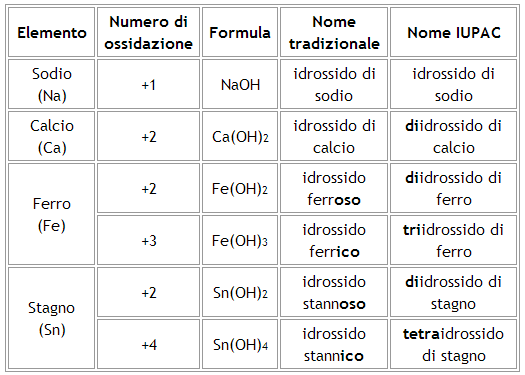
La nomenclatura tradizionale degli idrossidi prevede:
Se il metallo ha un solo un numero di ossidazione il composto si chiamerà “idrossido di” seguito dal nome del metallo.
Se il metallo presenta due numeri di ossidazione può formare due idrossidi diversi. Nell'idrossido a numero di ossidazione maggiore il metallo prenderà il suffisso -ico, in quello a numero di ossidazione minore prenderà il suffisso -oso.
La nomenclatura IUPAC prevede:
la denominazione “idrossido di” seguita dal nome del metallo, utilizzando anche opportuni prefissi che precedono il termine “idrossido”.
I prefissi dei nomi IUPAC corrispondono ai numeri che compaiono nelle formule (2 = di; 3 = tri; 4 = tetra; 5 = penta; 6 = esa; etc.).
Esercizi sulla nomenclatura
Se ti interessa svolgere esercizi sulla nomenclatura vai al seguente link: esercizi sulla nomenclatura chimica.
Quiz sulla nomenclatura chimica
Li trovi qui: quiz sulla nomenclatura chimica.
Relazione di laboratorio
Se sei interessato ad una relazione di laboratorio riguardante questi argomenti, vai al seguente link: preparazione di un idrossido.
Studia con noi