Elettroni di valenza
Che cosa sono e come si calcolano il numero di elettroni di valenza
Gli elettroni di valenza di un atomo sono gli elettroni presenti nel suo ultimo livello di energia; sono quelli che patecipano alla formazione dei legami chimici e sono quelli che determinano le proprietà chimiche di un elemento.
Gli elettroni di valenza sono indicati nella tavola periodica dal numero romano posto all'apice della colonna su cui è collocato l'elemento (gruppo).
Per esempio, H, Li, Na, K, Rb e Cs hanno tutti quanti un solo elettrone di valenza, infatti appartengono al gruppo I.
Be, Mg, Ca, Sr, Ba e Ra appartengono al gruppo II e quindi hanno due elettroni di valenza.
Ar, Kr, Xe, Rn appartengono al gruppo VIII e quindi hanno otto elettroni di valenza.
L'analisi della configurazione elettronica degli elementi, può far meglio comprendere il significato di elettroni di valenza.
Se consideriamo le configurazioni elettroniche di Li, Na e K
3Li = 1s2 2s1
11Na = 1s2 2s2 2p6 3s1
19K = 1s2 2s2 2p6 3s2 3p6 4s1
notiamo che tutte quante hanno un solo elettrone nell'ultimo livello di energia (hanno un solo elettrone di valenza) e quindi appartengono al gruppo I.
Anche gli elementi F, Cl, Br, I, At hanno proprietà chimiche simili perché hanno strutture elettroniche esterne simili.
Questi elementi infatti appartengono tutti al gruppo VII e infatti hanno tutti quanti sette elettroni di valenza. Per rendersene conto basta considerare le loro configurazioni elettroniche:
9F = 1s2 2s2 2p5
17Cl = 1s2 2s2 2p6 3s2 3p5
35Br = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5
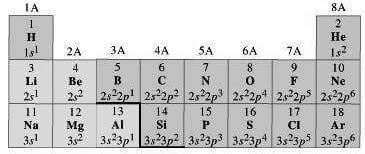
Il livello di energia occupato dagli elettroni di valenza corrisponde al periodo dell'elemento.
Studia con noi