Monossido di carbonio
Proprietà e caratteristiche del monossido di carbonio
Il monossido di carbonio (o ossido di carbonio) è un gas incolore ed inodore, di densità 0,967 g/cm3 e formula chimica CO.
Ha temperatura di ebollizione pari a -191,4°C e temperatura di fusione di -205°C; 1 litro di acqua a 0°C e alla pressione normale discioglie 35 cm3 di monossido di carbonio, a 15°C ne discioglie 25 cm3.
Il monossido di carbonio fu ottenuto da Lasonne (1776) riscaldando l'ossido di zinco con il carbone, e da Priestley (1796) riscaldando l'ossido di ferro col carbone, ma senza che ne fosse riconosciuta la natura.
Nel 1796, Cruikshank riconobbe che bruciando, il monossido di carbonio produceva anidride carbonica (gas silvestre) ma non acqua.
La composizione chimica del monossido di carbonio fu stabilita da Clèment e Dèsormes i quali ne riconobbero anche la velenosità.
La denominazione di ossido di carbonio è dovuta a Berzelius.
Nel 1808 Gay-Lussac dimostrò che 2 volumi di monossido di carbonio fatti detonare con 1 volume di ossigeno danno 2 volumi di anidride carbonica e all'analisi ottenne per la composizione dell'ossido di carbonio dati estremamente precisi: 42,99% C e 57,01% O invece di 42,85% e 57,15% rispettivamente per il C e l'O.
Per quanto il monossido di carbonio si trovi in piccole quantità occluso nel carbone fossile, in alcune meteoriti e talvolta nelle emanazioni vulcaniche, esso si riscontra nell'atmosfera dei centri abitati a causa della incompleta combustione del carbone o degli oli minerali; nell'aria dei grandi centri abitati è sempre presente soprattutto nei gas di scarico degli autoveicoli.
Il monossido di carbonio si forma infatti in seguito ad una combustione in difetto di ossigeno del carbonio o dei composti che lo contengono, oppure nel caso in cui la combustione venga fatta avvenire in presenza di una sufficiente quantità di ossigeno ma ad altissime temperature (ed è per questo che uno dei componenti dei gas di scarico delle autovetture).
L'ossido di carbonio è presente nei gas di distillazione e di gassificazione dei combustibili fossili (gas domestico, gas di cokeria, gas d'acqua, gas d'aria) e nei vari gas industriali, principalmente nel gas d'altoforno.
Produzione di monossido di carbonio
Allo stato puro il monossido di carbonio lo si ottiene nell'industria come prodotto secondario della liquefazione del gas di cokeria, nella preparazione dell'idrogeno per la sintesi dell'ammoniaca, oppure con la reazione:
![]()
nota anche come reazione di reversione, reazione del gas dei generatori o equilibrio di Boudouard, dal nome del fisico-chimico francese, allievo di Le Chatelier, che ne studiò per primo l'equilibrio.
Struttura del monossido di carbonio
Nella molecola CO l'atomo C è formalmente bivalente (C=O) e la struttura di questa molecola è stata molto discussa; la stabilità della molecola di CO può essere attribuita ad un elevato valore dell'energia di risonanza tra forme covalenti e forme covalenti-polari:
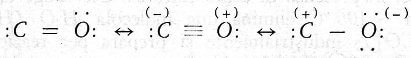
i cui pesi sono 20% per la forma covalente e, rispettivamente, 50% e 30% per le due forme covalenti polari.
Tossicità del monossido di carbonio
Il monossido è un gas estremamente velenoso: un uomo adulto trova la morte entro 30 minuti in un ambiene contenente lo 0,1% di CO.
Le normali maschere antigas sono inefficaci verso questo gas e pertanto devono essere dotate di speciali filtri a base di ossido di manganese che riescono a trasformare il CO in anidride carbonica.
Il complesso stabile emoglobina-monossido di carbonio prende il nome di carbossiemoglobina.
Usi dell'ossido di carbonio
L'ossido di carbonio è un composto di grande importanza per l'industria ma in generale esso non viene impiegato allo stato puro che raramente.
Il monossido di carbonio trova impiego in siderurgia, nei processi di ossosintesi e nella produzione di ammoniaca e dell'alcol metilico.
Studia con noi