Cloruro di ammonio
Proprietà e caratteristiche del cloruro di ammonio
Il cloruro di ammonio è un sale con formula chimica NH4Cl.
In natura esiste in piccole quantità nei giacimenti salini e carboniferi, ed è presente nelle emanazioni vulcaniche, come prodotto di sublimazione.
Proprietà fisiche del cloruro di ammonio
Il cloruro di ammonio NH4Cl cristallizza nel sistema rombico, con due modificazioni (a corpo centrato ed a facce centrate; temperatura di trasformazione 184,5 °C).
Esso presenta inoltre un punto di transizione a -30,54 °C (punto λ o di trasformazione di seconda specie), corrispondente alla libera rotazione dello ione ammonio NH4+ all'interno del reticolo cristallino.
L'habitus normale è trapezoidale, ma viene facilmente modificato se la cristallizzazione è fatta avvenire in presenza di altre sostanze: è anche frequente la formazione di dentriti.
Come si verifica per tutti gli alogenuri ammonici, anche il cloruro di ammonio sublima inalterato; i suoi vapori sono infatti completamente dissociati in NH3 e HCl, che si ricombinano per raffreddamento.
![]()
Il cloruro di ammonio è molto solubile in acqua (391,8 g/L a 25 °C) e poco solubile negli alcoli metilico (metanolo) ed etilico (etanolo).
Proprietà chimiche del cloruro di ammonio
Il cloruro di ammonio secco, a caldo, è fortemente aggressivo nei confronti di molti metalli; ciò è dovuto alla presenza dello ione ammonio NH4+, capace di rilasciare un protone :
![]()
Anche molti ossidi metallici reagiscono con NH4Cl secco od in soluzione dando luogo ai rispettivi cloruri e questo spiega il comune impiego di questo sale come disossidante (saldatura, galvanizzazione).
Con acido nitrico, od altri ossidanti energici, sviluppa cloro e cloruro di nitrosile (NOCl):
8 HNO3 + 6 NH4Cl → 2 NOCl + 2 Cl2 + 6 N2 + 3 O2 + 16 H2O
Il cloruro di ammonio reagisce con le basi forti (come ad esempio NaOH) , liberando ammoniaca (NH3):
NH4Cl + NaOH → NH3 + NaCl + H2O
In modo simile il cloruro di ammonio reagisce con i carbonati dei metalli alcalini a temperature elevate, formando ammoniaca, CO2, H2O e il cloruro del metallo alcalino:
2 NH4Cl + Na2CO3 → 2 NaCl + CO2 + H2O + 2 NH3
Le soluzioni acquose di concentrazione maggiore del 5% attaccano facilmente l'acciaio dolce e la ghisa; il rame, l'ottone e il bronzo sono poco attaccati in assenza d'aria, mentre gli acciai inossidabili e quelli al silicio presentano una buona resistenza in tutte le condizioni operative e vengono pertanto preferiti nella costruzione delle apparecchiature industriali.
pH di una soluzione di cloruro di ammonio
In soluzione acquosa il cloruro di ammonio è completamente dissociato nei suoi ioni:
NH4Cl → NH4+ + Cl−
Mentre lo ione Cl- non dà reazione di idrolisi, lo ione ammonio NH4+ dà idrolisi acida:
NH4+ + H2O → NH3 + H3O+
Pertanto il pH di una soluzione di cloruro di ammonio è acido.
Per approfondimenti si veda: calcolo del pH di una soluzione di cloruro di ammonio.
Preparazione del cloruro di ammonio
Industrialmente il cloruro di ammonio può essere ottenuto attraverso due processi diversi.
Il primo processo utilizza le soluzioni finali del ciclo Solvay basato sulla reazione:
NaCl + NH4HCO3 → NaHCO3 + NH4Cl
Il secondo processo prevede la neutralizzazione diretta tra ammoniaca e cloruro di idrogeno:
NH3(g) + HCl(g) → NH4Cl(s)
Impieghi del cloruro di ammonio
I principali impieghi del cloruro di ammonio riguardano la preparazione delle batterie a secco, le operazioni di saldatura e zincatura (dove agisce da disossidante), e la preparazione di fertilizzanti, specie per le risaie, dove l'abbondanza d'acqua riduce gli inconvenienti legati alla forte concentrazione di cloro-ione.
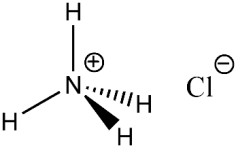
Struttura del cloruro di ammonio
Ioni equivalenti: NH4+ , Cl−
Studia con noi