Cloruro di sodio
Proprietà e caratteristiche del cloruro di sodio
Il cloruro di sodio è un sale binario con formula chimica NaCl (per maggiori info si veda: formula chimica del sale da cucina).
Nella vita quotidiana è noto semplicemente come sale o sale da cucina.
È una sostanza indispensabile nell'alimentazione poiché entrambi gli elementi che lo compongono hanno importanti funzioni fisiologiche.
Per tale ragione viene ancora oggi usato spesso come merce di scambio in regioni che ne sono prive.
Esso è inoltre importante quale materiale di partenza per la preparazione di composti di cloro e di sodio.
Proprietà del cloruro di sodio
Il cloruro di sodio (39,337% di sodio e 60,663% di cloro in peso) cristallizza monometrico, principalmente in cubi, più raramente in ottaedri o rombododecaedri; aggregati di cristalli cubici possono simulare una piramide quadrata.
Sono inoltre caratteristici cristalli cubici con le facce concave ed a gradini (cristalli a tramoggia).
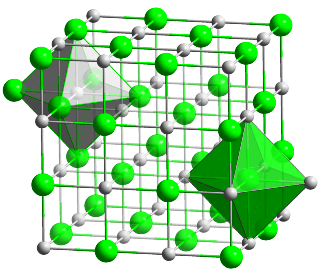
Struttura cristallina del cloruro di sodio.
Il cloruro di sodio puro è incolore e, a differenza del vetro, è trasparente nel vicino e medio-infrarosso, da cui l'uso nell'ottica in apparecchiature scientifiche.

Cristallo di NaCl
Colorazioni caratteristiche ai cristalli di cloruro di sodio possono essere impartite da impurezze di ferro (rosso) e ioni sodio interposti nel reticolo (salgemma trasparente azzurro).
Il cloruro di sodio è leggermente solubile in metanolo (1,40 g/100 g di solvente), etanolo (0,065), acido formico (5,21), glicol etilenico (7,15) e in ammoniaca liquida (2,15 g/g di solvente a -40°C).
La solubilità in acqua del cloruro di sodio cresce poco con la temperatura; 100 g di acqua sciolgono a 0°C 35,6 g di NaCl, mentre la stessa quantità di acqua a 100°C scioglie 39,8 g di NaCl.
Soluzioni acquose di NaCl hanno pH neutro (pH = 7), in quanto i due ione Na+ e Cl− non danno reazione di idrolisi.
Al riguardo ti potrebbe interessare: pH di una soluzione di cloruro di sodio.
A pressione normale la soluzione satura di cloruro sodico bolle a 108,6 °C, contiene il 28,41% di sale anidro, ha una densità di 1,204.
Il cloruro di sodio in natura
Il cloruro di sodio si trova in natura allo stato di soluzione nell'acqua del mare e di alcune sorgenti ed allo stato solido quale salgemma.
Il contenuto di cloruro di sodio dell'acqua del mare varia poco nei grandi oceani, dove si mantiene attorno al 3,0%, mentre presenta notevoli variazioni nei bacini minori.
Il contenuto di sale è solo dello 0,7% nel Mar Baltico, mentre raggiunge il 3,3% nel Mediterraneo ed il 3,5% nel Mar Rosso.
Nei mari interni senza affluenti importanti il contenuto in sali può salire a valori assai elevati, così il Mar Morto, accanto a grandi quantità di altri sali, contiene circa il 20% di cloruro di sodio.
I giacimenti di salgemma, le principali fonti del sale usato nell'industria, si sono formati per evaporazione di bacini salati.
Preparazione del cloruro di sodio
Il cloruro di sodio si ottiene principalmente con tre metodi:
- per estrazione del salgemma dalle miniere;
- per evaporazione delle soluzioni naturali (sorgenti di acque salse) o di quelle provenienti dalla dissoluzione del salgemma, mediante calore ottenuto da combustibile;
- dall'acqua del mare o di taluni laghi salati lasciandola evaporare mediante il calore solare o, nei paesi freddi, facendola congelare.
Sale dalle miniere
Lo sfruttamento dei giacimenti di salgemma che richiedono notevoli lavori di scavo, è conveniente solo dove esso si presenta in grandi masse con poche impurezze.
Il grado di purezza varia da giacimento a giacimento ed anche nello stesso giacimento da punto a punto.
Il sale più puro, di solito, si trova al centro della sezione verticale dello strato, quello meno puro ai bordi.
L'analisi di un solo campione non può quindi dare la composizione del giacimento.
Sale per evaporazione delle soluzioni
Il salgemma meno puro può essere estratto nel seguente modo.
Il giacimento sotterraneo viene raggiunto trivellando pozzi con metodi analoghi a quelli usati per i pozzi acquiferi, petroliferi e metaniferi. Quando il pozzo è aperto si innestano in esso due tubi coassiali lungo uno dei quali si fa scendere al fondo del giacimento dell'acqua pura che scioglie il sale, mentre la salamoia formata, mediante aria in pressione o per mezzo di centrifughe, viene portata alla superficie attraverso il secondo tubo.
La salamoia che proviene dai pozzi è satura o quasi ed in generale è relativamente pura.
L'impurezza principale è costituita da solfato di calcio; la salamoia contiene inoltre composti di ferro, solfuri e spesso idrogenocarbonati, sali di calcio e di magnesio principalmente allo stato di cloruri o solfati.
I gas disciolti si eliminano per aerazione.
Per la preparazione di sale ad elevato grado di purezza, come è richiesto per l'alimentazione e per altri usi, il ferro, il calcio, il magnesio e le altre vengono eliminati mediante aggiunta di soda caustica e decantazione della salamoia in larghi bacini.
Il sale raffinato, detto anche sale a vuoto, viene prodotto in grandi evaporatori a vuoto.
Evaporazione col calore solare
Nei paesi a temperatura abbastanza elevata il sale si ottiene evaporando l'acqua del mare o di laghi interni mediante l'azione del calore solare e del vento nelle cosiddette saline.
Il principio dell'estrazione è rimasto quello primitivo. Approfittando dell'alta marea, si riempiono larghi bacini poco profondi, dai quali l'acqua salata passa ad altri, dove si concentra per poi raccogliersi nell'ultimo nel quale cristallizza.
Usi del cloruro di sodio
Gli usi del cloruro di sodio si possono distinguere in alimentare ed industriale.
Circa un terzo della produzione mondiale di sale viene utilizzata a scopo alimentare, sia come condimento di cibi, sia nella conservazione della carne, del pesce, nelle industrie casearie e conserviere, sia nella panetteria.
Anche nell'alimentazione del bestiame il cloruro di sodio ha importanza quale fonte di sali minerali.
Esso si usa inoltre in medicina, in soluzioni isotoniche per le ipodermoclisi.
Tuttavia oltre metà della produzione viene utilizzata per la fabbricazione di altri composti chimici e in alcuni processi industriali come ad esempio:
soda solvay; produzione elettrolitica di cloro e soda caustica; produzione elettrolitica di sodio; preparazione del cloruro di nitrosile; produzione di idrogenosolfato di sodio; produzione elettrolitica dei clorati.
Il sale viene inoltre usato, in quantità crescente, contro la neve ed il ghiaccio sulle strade e quale stabilizzante nella costruzione di massicciate.
Serve inoltre per rigenerare resine scambiatrici di ioni (addolcimento delle acque tramite addolcitore), nella concia del cuoio (prevenzione della decomposizione batterica), nella tintura dei tessuti, manifattura dei saponi, della cellulosa e carta, metallurgia (bagni fusi), ceramica, gomma, industria del freddo (miscele frigorifere o refrigeranti) e nell'industria del petrolio (prevenzione della fermentazione nei fanghi dei pozzi e della dissoluzione degli strati di salgemma nella perforazione).
Studia con noi