Solfato di sodio
Proprietà e caratteristiche del solfato di sodio
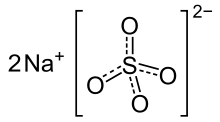
Il solfato di sodio è un sale ternario con formula chimica Na2SO4.
Il solfato di sodio forma un decaidrato, Na2SO4·10H2O (sale di Glauber), ed un eptaidrato, Na2SO4·7H2O, metastabile.
Il sale anidro si trova in natura come thenardite.
Proprietà del solfato di sodio
Il solfato di sodio anidro è un sale stabile da un punto di vista chimico.
Ad alte temperature può reagire con il carbone fomando il solfuro di sodio:
Na2SO4 + 2 C → Na2S + 2 CO2
Il solfato di sodio reagisce inoltre con l'acido solforico formando bisolfito di sodio:
Na2SO4 + H2SO4 ⇄ 2 NaHSO4
Struttura del solfato di sodio
Il solfato di sodio è un tipico composto ionico formato da ioni Na+ ed SO42−.
L'esistenza degli ioni solfato (SO42−) in soluzione è dimostrabile in seguito alla formazione di solfati insolubili quando la soluzione viene trattata con ioni Pb2+ o ioni Ba2+:
Na2SO4(aq) + BaCl2(aq) → 2 NaCl(aq) + BaSO4(s)
Preparazione del solfato di sodio
Il metodo più importante di preparazione del solfato sodico è la reazione del cloruro di sodio con l'acido solforico:
2 NaCl + H2SO4 → Na2SO4 + 2 HCl
Il solfato di sodio si ottiene come sottoprodotto di vari processi, quali la preparazione del bicromato sodico dal cromato, dell'acido formico dal formiato sodico, del fenolo (acido fenico) dal benzene attraverso il benzensolfonato sodico.
Il solfato di sodio si ottiene anche quale sottoprodotto dalle acque madri della preparazione del cloruro di potassio. Queste contengono cloruro di sodio e solfato di magnesio.
Da queste soluzioni cristallizza a bassa temperatura il sale idrato, Na2SO4·10H2O, in base alla reazione di doppio scambio:
2 NaCl + MgSO4 → MgCl2 + Na2SO4
Negli ultimi anni si è molto sviluppata l'estrazione del solfato sodico dalle acque di sorgenti naturali.
Inoltre sono stati scoperti giacimenti di solfato sodico negli Stati Uniti (Arizona), nel Cile ed in Asia centrale. I giacimenti dell'Arizona contengono circa il 90% di solfato facilmente estraibile.
Si può ottenere solfato sodico anche per disidratazione del sale di Glauber, di cui si trovano nel Canada (Saskatehewan) estesi giacimenti. Il sale di Glauber estratto da sorgenti naturali può essere disidratato in forni rotativi o con altri processi.
Usi del solfato di sodio
Il solfato di sodio viene utilizzato principalmente nella produzione della cellulosa che ne assorbe oggi circa i ¾ della produzione totale.
Di grande importanza è anche l'uso del solfato di sodio come diluente dei detersivi sintetici, che normalmente contengono dal 50 al 75% di Na2SO4 ed hanno di conseguenza portato ad un ulteriore incremento del suo consumo e della sua produzione.
Il solfato sodico è pure molto usato nella preparazione del vetro, dei coloranti e nella estrazione del nichel e come prodotto di partenza di molti composti di sodio, come il solfuro, il sale di Glauber, il silicato, il tiosolfato e l'allume.
Viene inoltre usato nell'alimentazione del bestiame come fonte di zolfo per alcune proteine.
Ricordiamo infine il fatto che il solfato di sodio può essere impiegato come coleretico.
Studia con noi