Saponi
Azione dei saponi
I grassi naturali (lipidi), noti anche con il nome di trigliceridi sono esteri della glicerina.
Essi subiscono facilmente idrolisi basica (in un processo noto con il nome di saponificazione) formando glicerolo e sali degli acidi grassi.
I sali di sodio e potassio degli acidi grassi a lunga catena che si ottengono nel processo di saponificazione costituiscono i saponi.
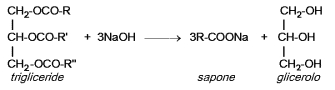
Struttura dei saponi
I saponi sono detergenti costituiti da sali di sodio o di potassio degli acidi grassi a lunga catena di atomi di carbonio (10-18 atomi di C). Esempio di acidi grassi coinvolti nella preparazione dei saponi sono il laurico, il miristico, il palmitico, lo stearico e altri.
Da un punto di vista chimico i saponi sono tensioattivi (sostanze in grado di far variare la tensione superficiale di un liquido) caratterizzati dal fatto di possedere una struttura anfipatica, ovvero di contenere sia un gruppo idrofilo e quindi polare (ione carbossilato) sia un gruppo idrofobo e quindi apolare.

Struttura di un acido grasso (acido stearico).
Azione detergente dei saponi
L'acqua non è in grado di solubilizzare i grassi (lipidi); ciò è dovuto ad una totale immiscibilità tra l'acqua (polare) e il grasso (apolare).
Tuttavia la presenza in acqua di molecole di sapone cambia l'assetto generale della situazione.
Infatti le molecole di sapone si orientano in modo tale che la loro coda idrofoba (e quindi lipofila) sia "immersa" nella grasso mentre la loro testa idrofila sia orientata verso l'acqua (si veda immagine seguente).
Questo processo si ripete sino a quando tutta la macchia di grasso è circondata dalle molecole di detergente.
L'azione detergente dei saponi è dovuta a questa organizzazione nella quale - come detto - la particella di grasso è inglobata al centro di una micella nella quale le molecole di sapone affondono la coda lipofila verso il grasso e orientano la testa polare verso l'acqua.
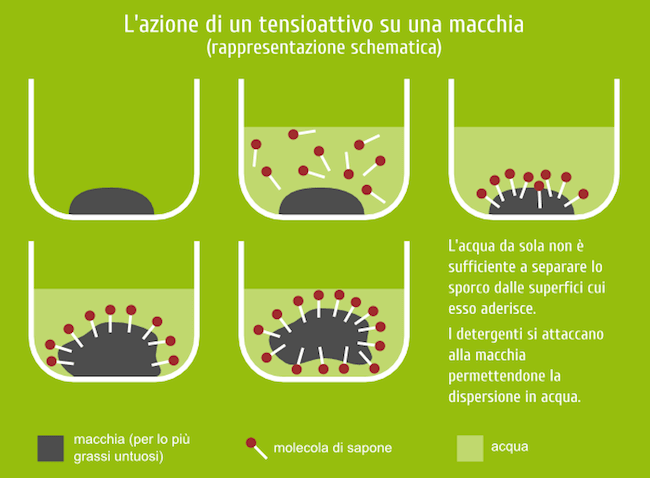
Rappresentazione dell'azione detergente di un sapone. La molecola di sapone ha una testa polare (in rosso) e una cosa apolare (in bianco).
La particella di grasso inizialmente insolubile in acqua viene circondata dalle teste polari idrofile delle molecole del sapone che la rendono solubile.
Le teste idrofile dei saponi conferiscono alla micella la necessaria idrofilicità necessaria per permettere l'allontanamento dell'unto per sfregamento e successivo risciacquo.
Limiti dei saponi
Il limite principale dei saponi è che possono essere utilizzati solo in acque non particolarmente ricche di ioni calcio e ioni magnesio e in acque non particolarmente acide.
In presenza di acque dure infatti il sapone precipita come sale di calcio e smette di svolgere la sua azione detergente.
2 R-COO−Na+(aq) + Ca2+(aq) → (R-COO−)2Ca2+(s) + 2 Na+(aq)
In presenza di acque acide il sapone precipita invece come acido grasso anch'esso insolubile in acqua.
R-COO−Na+(aq) + H+(aq) → R-COOH(s) + Na+(aq)
Come preparare artigianalmente un sapone
La descrizione la trovi qui: preparazione di un sapone.
Link correlati:
Qual è il pH di un sapone neutro?
Studia con noi